Bukspottkörtelcancer
| Bukspottkörtelcancer | |
| Latin: cancer pancreatis | |
 | |
| Klassifikation och externa resurser | |
|---|---|
| ICD-10 | C25 |
| ICD-9 | 157 |
| OMIM | 260350 |
| DiseasesDB | 9510 |
| Medlineplus | 000236 |
| eMedicine | med/1712 |
| MeSH | svensk engelsk |


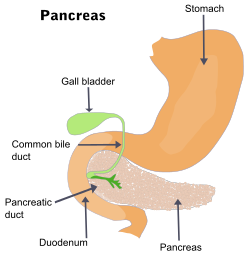
Bukspottskörtelcancer eller pankreascancer är cancer i bukspottkörteln.[1] Bukspottskörtelcancer uppstår när celler i bukspottkörteln, ett körtelorgan bakom magsäcken, börjar föröka sig utom kontroll och bildar en cellmassa. Dessa cancerceller har förmåga att invadera andra delar av kroppen och bilda så kallade metastaser.[2] Det finns ett antal olika typer av cancrar med ursprung i bukspottskörteln. Den vanligaste, pankreatiskt adenocarcinom, står för cirka 85 procent av fallen. Dessa adenocarcinom börjar växa i den del av bukspottkörteln som bildar matsmältningsenzymer. En till två av varje hundra fall är så kallade neuroendokrina tumörer, som utgår från hormonproducerande celler i bukspottkörteln. Dessa är i allmänhet mindre aggressiva. Symptom på den vanligaste formen av cancer i bukspottskörteln är gulsot, smärta i buken eller ryggen, ofrivillig viktnedgång, blek avföring, mörk urin och aptitförlust. Vanligtvis märks inga symptom i sjukdomens tidiga skeden, och symptom som är specifika nog att leda misstanke till cancer i bukspottskörteln utvecklas normalt inte förrän sjukdomen har nått ett senare eller avancerat stadium.[3] Vid tidpunkten för diagnos har cancerceller ofta spridit sig till andra delar av kroppen.[4][5]
Pankreascancer förekommer sällan före 40 års ålder, och mer än hälften av fallen av pankreatiskt adenocarcinom uppstå bland dem som är över 70 års ålder.[6] Riskfaktorer för cancer i bukspottskörteln är tobaksrökning, fetma, diabetes och vissa sällsynta genetiska tillstånd.[6] Cirka 25 procent av fallen är kopplade till rökning,[7] och 5–10 procent är kopplade till ärvda gener.[6] Cancer i bukspottskörteln diagnostiseras vanligen via en kombination av medicinsk bildtagning såsom ultraljud eller datortomografi, blodprov och undersökning av vävnadsprover.[3]
Pankreascancer delas upp i olika sjukdomsfaser: från tidig (grad I) till sen (grad IV).[4] Screening har inte visat sig vara effektivt på befolkningsnivå.[8]
För att förhindra cancer i bukspottskörteln hjälper det att hålla en hälsosam vikt och begränsa konsumtionen av rött eller processat kött.[9] Hos rökare minskar risken att utveckla sjukdomen om de slutar röka och risken är lika låg som resten av befolkningen efter 20 års uppehåll.[5] Cancer i bukspottskörteln kan behandlas med kirurgi, strålbehandling, kemoterapi, palliativ vård eller en kombination av dessa. Vilka behandlingsalternativ som är möjliga att tillgå är delvis baserat på cancerstadiet. Kirurgi är den enda behandling som kan bota sjukdomen, men kan också användas för att försöka förbättra livskvaliteten även när det inte finns någon möjlighet att bota sjukdomen.[3] Smärtbehandling och läkemedel som förbättrar matsmältningen kan ibland behövas.[4] Tidig palliativ vård rekommenderas bland dem som får behandling med syfte att bota cancern.[10][11]
Under år 2012 stod pankreascancer som den sjunde vanligaste orsaken till dödsfall i cancer och resulterade i 330 000 dödsfall globalt.[5] I USA är cancer i bukspottskörteln den fjärde vanligaste orsaken till dödsfall i cancer.[12][13] Sjukdomen är vanligast i den utvecklade världen, som stod för cirka 70 procent av alla nya fall år 2012.[5] Pankreatiskt adenocarcinom har vanligen en mycket dålig prognos: 25 procent av människor lever ett år efter diagnos och 5 procent lever efter fem år.[5][14] För cancrar som upptäcks tidigt är femårsöverlevnaden något högre på cirka 20 procent.[15] Neuroendokrin cancer har bättre utfall och ungefär 65 procent av de drabbade är i livet efter fem år.[5]
Symptom
[redigera | redigera wikitext]Buksmärtor och kraftig viktnedgång är vanliga symptom. Multipla ytliga venproppar kan ibland förekomma. Cancern kan även växa så mycket att den blockerar bland annat gallvägar. Ultraljud och datortomografi används för att visualisera tumören.
Om bukspottkörtelcancern upptäcks i ett mycket tidigt skede kan bot erhållas genom att bukspottskörteln opereras bort (pankreatektomi). I de flesta fall ger dock cancern inga symptom förrän tillväxten gått så långt att botande behandling ej längre är möjlig. Den har då oftast redan hunnit sprida sig till levern. Dödligheten för personer med bukspottkörtelcancer är därför mycket hög och är 100 procent efter tio år för den majoritet där tidig operation ej kunnat genomföras.
Neuroendokrina bukspottkörteltumörer
[redigera | redigera wikitext]Neuroendokrina bukspottkörteltumörer eller neuroendokrina pankreastumörer (panNETs) är tumörer som utgår från neuroendokrina ö-cellerna i pankreas. Med en årlig incidens på 0,12-0,4 per 100 000[16] .Dessa tumörer kan vara funktionella (hormonproducerande, ca 30 %[17]) eller icke-funktionella (icke-hormonproducerande, ca 60-90 %[18][16]) och beroende på vilket hormon som produceras, får patienten olika symtom. Funktionella panNET är mer sällsynta och kan utsöndra organspecifika hormoner så som: insulin, gastrin, vasoaktiv intestinal peptid (VIP), glukagon, somatostatin och serotonin. Funktionella panNET kan även utsöndra andra hormoner som inte är organspecifika, så kallad ektopisk hormon utsöndring[18] så som adrenokortikotropt hormon (ACTH), tillväxthormon (GH) eller serotonin.
Majoriteten av fallen förekommer sporadiskt. Ungefär 10 % av panNETs uppskattas vara hereditära och del av olika genetiska syndrom som ger upphov till multipla tumörer, inte bara i paneras men även i extrapankreatiska organ. Det vanligaste ärftliga syndromet är multipel endokrin neoplasi typ 1 (MEN 1), följt av Von-Hippel-Lindaus syndrom, neurofibromatos typ 1 och tuberös skleros. Funktionella panNETs förekommer övervägande i MEN1, där de står för cirka 30 % av fallen och inkluderar huvudsakligen insulinom och duodenala gastrinom[17].
Histopatologi
[redigera | redigera wikitext]Den senaste WHO-klassificeringen från 2019[19] för neuroendokrina tumörer i mag-tarmkanalen bygger på Ki67-index och mitosräkning och särskiljer på två grupper:
- Neuroendokrina tumörer (NET) grad 1, 2 och 3.
- Neuroendokrin cancer (NEC).
Malignitetspotentialen återspeglas i tumörgraden (G1–G3), där andelen prolifererande tumörceller är av avgörande betydelse. Andelen prolifererande tumörceller bestäms genom analys av Ki67-index och mitosräkning. NET (grad (G)1 (Ki67<1 %), G2 (Ki67 3-20 %),G3 (Ki67 >20 %)) uppvisar ofta ett karakteristiskt tillväxtmönster med minimal atypi, medan NEC (G3 Ki67 >20 %) vanligtvis uppvisar ett fast tillväxtmönster med omfattande nekros av tumörceller och en hög grad av cellulär atypi. [19][20]
TNM-klassificeras som för adenomkarcinom[21].
Zollinger-Ellisons syndrom (gastrinom)
[redigera | redigera wikitext]Gastrinom kallas gastrinproducerande neuroendokrina tumörer och kan uppkomma i bukspottkörteln (10 %–40 %) eller i tolvfingertarmen (60 %—80 %). Gastrin främjar produktionen av magsyra, och den överdrivna utsöndringen från gastrinom ökar således kraftigt risken för att utveckla magsår och andra tarmsår[22]. Diarré är också ett vanligt förekommande symtom. Detta utgör ett syndrom som kallas för Zollinger-Ellisons syndrom. Metastaser uppkommer i drygt hälften av fallen.
Insulinom
[redigera | redigera wikitext]Insulinom, insulinproducerande panNETs, är huvudsakligen begränsade till bukspottkörteln och utgör de vanligaste fungerande panNETs. Årlig incidens på 0,7-1,3 fall per miljon/år [23]. Majoriteten är benigna (ca 90%[24]) men det förekommer även maligna tumörer med mer aggressivt sjukdomsförlopp och låg överlevnad[25]. Den höga utsöndringen av insulin bidrar till sjukdomsbilden, med symtom relaterade till hypoglykemi. Långtidsfasta, (72-timmarsfasta) anses vara en effektiv diagnostisk metod med nära 100 % känslighet och specificitet. Klassiska symtom på hypoglykemi uppstår vanligtvis efter 12 timmars fasta, och de första 48 timmarna lider de flesta av Whipples triad[24], vilket innebär följande: hypoglykemiska symtom, lågt blodsocker och symtomlindring efter glukoskorrigering. Symtom på hypoglykemi kan vara svettningar, synpåverkan, hjärtklappning, ångest och förvirring.
Glukagonom
[redigera | redigera wikitext]Glukagonom, ofta förknippade med MEN1, utsöndrar höga nivåer av glukagon som är ett hormon som produceras av bukspottskörteln alfaceller. De kännetecknas av symtom som nekrotiskt migrerande erytem, viktförlust, hypoalbuminemi och diabetes mellitus eller nedsatt glukostolerans. Emellertid kan förhöjda glukagonnivåer, också förekomma i andra tillstånd som cirros, diabetes, sepsis och brännskador.
VIPom
[redigera | redigera wikitext]PanNETs som utsöndrar vasoaktiv intestinal peptid VIP, så kallade VIPom, är en sällsynt subtyp av pankreatiska ö-cellstumörer. De leder till Verner-Morrisons syndrom: vattenlik /koleraliknande diarré, uttalade elektrolytrubbningar så som hypokalemi och achlorhydria. Metastaserad sjukdom förekommer i 50-89% av VIPomer redan vid diagnosen[26].
Somatostatinom
[redigera | redigera wikitext]Somatostatinproducerande NET, somatostatinom, är sällsynta bland funktionella NET och prevalensen uppskattas till endast en av 40 miljoner. Efter den första beskrivningen av ett pankreas somatostatinom 1977, har det rapporterats mindre än 100 fall i litteraturen[27]. Dessa tumörer orsakar en klassisk triad av syndrom: hyperglykemi, gallsten och nedsatt matsmältning på grund av somatostatins hämmande effekt på magsäck och gallblåsa.
Referenser
[redigera | redigera wikitext]Noter
[redigera | redigera wikitext]- ^ Klepp, Olbjørn (21 augusti 2014). ”bukspyttkjertelkreft”. Store medisinske leksikon. Foreningen SNL. https://sml.snl.no/bukspyttkjertelkreft. Läst 3 juli 2016.
- ^ ”What is Cancer? Defining Cancer”. National Cancer Institute. National Institutes of Health. 7 mars 2014. http://www.cancer.gov/cancertopics/cancerlibrary/what-is-cancer. Läst 5 december 2014.
- ^ [a b c] ”Pancreatic Cancer Treatment (PDQ®) Patient Version”. National Cancer Institute. National Institutes of Health. 17 april 2014. http://www.cancer.gov/cancertopics/pdq/treatment/pancreatic/Patient/page1/AllPages. Läst 8 juni 2014.
- ^ [a b c] Bond-Smith G, Banga N, Hammond TM, Imber CJ (2012). ”Pancreatic adenocarcinoma”. BMJ (Clinical research ed.) "344": s. e2476. doi:. PMID 22592847. Arkiverad från originalet den 9 januari 2015. https://web.archive.org/web/20150109071550/http://www.wessexcolorectalclinic.com/app/download/5789745892/2012_PancreaticAdenocarcinoma_BMJ.pdf. Läst 30 juni 2016.
- ^ [a b c d e f] . ISBN 92-832-0429-8
- ^ [a b c] Ryan DP, Hong TS, Bardeesy N (2014). ”Pancreatic adenocarcinoma”. ""371"". s. 1039–49. doi:. PMID 25207767. Arkiverad från originalet den 26 december 2014. https://web.archive.org/web/20141226144755/http://www.enotes.us/Pancreatic_Ca2014.pdf. Läst 30 juni 2016.
- ^ ”Recent progress in pancreatic cancer” (
 PDF). CA: a Cancer Journal for Clinicians "63" (5): s. 318–48. 2013. doi:. PMID 23856911. PMC: 3769458. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3769458/pdf/nihms464911.pdf.
PDF). CA: a Cancer Journal for Clinicians "63" (5): s. 318–48. 2013. doi:. PMID 23856911. PMC: 3769458. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3769458/pdf/nihms464911.pdf.
- ^ Bussom S, Saif MW (5 mars 2010). ”Methods and rationale for the early detection of pancreatic cancer. Highlights from the "2010 ASCO Gastrointestinal Cancers Symposium". Orlando, FL, USA. January 22–24, 2010”. JOP : Journal of the pancreas "11" (2): s. 128–3 0. PMID 20208319. Arkiverad från originalet den 8 december 2014. https://web.archive.org/web/20141208001305/http://www.joplink.net/prev/201003/19.html. Läst 30 juni 2016.
- ^ ”Can pancreatic cancer be prevented?”. American Cancer Society. 11 juni 2014. Arkiverad från originalet den 13 november 2014. https://web.archive.org/web/20141113184749/http://www.cancer.org/cancer/pancreaticcancer/detailedguide/pancreatic-cancer-prevention. Läst 13 november 2014.
- ^ Shahrokni A, Saif MW. ”Metastatic pancreatic cancer: the dilemma of quality vs. quantity of life” (
 PDF). JOP : Journal of the pancreas (4): s. 391–4. doi:. PMID 23846935. http://www.serena.unina.it/index.php/jop/article/view/1663/1740.
PDF). JOP : Journal of the pancreas (4): s. 391–4. doi:. PMID 23846935. http://www.serena.unina.it/index.php/jop/article/view/1663/1740.
- ^ Bardou M, Le Ray I (2013). ”Treatment of pancreatic cancer: A narrative review of cost-effectiveness studies”. Best practice & research. Clinical gastroenterology "27" (6): s. 881–92. doi:. PMID 24182608. https://www.sciencedirect.com/science/article/abs/pii/S1521691813001911?via%3Dihub.
- ^ ”Analysis of mortality rates for pancreatic cancer across the world” (
 PDF). HPB "10" (1): s. 58–62. 2008. doi:. PMID 18695761. PMC: 2504856. https://www.hpbonline.org/action/showPdf?pii=S1365-182X%2815%2930015-0.
PDF). HPB "10" (1): s. 58–62. 2008. doi:. PMID 18695761. PMC: 2504856. https://www.hpbonline.org/action/showPdf?pii=S1365-182X%2815%2930015-0.
- ^ ”Lifetime Risk of Developing or Dying From Cancer”. American Cancer Society. 1 oktober 2014. Arkiverad från originalet den 25 november 2016. https://web.archive.org/web/20161125234039/http://www.cancer.org/cancer/cancerbasics/lifetime-probability-of-developing-or-dying-from-cancer. Läst 1 december 2014.
- ^ ”Cancer Facts & Figures 2010” (PDF). American Cancer Society. 21 december 2010. Arkiverad från originalet den 14 januari 2015. https://web.archive.org/web/20150114080100/http://www.cancer.org/acs/groups/content/%40nho/documents/document/acspc-024113.pdf. Läst 5 december 2014.
- ^ ”Pancreatic Cancer Treatment (PDQ®) Health Professional Version”. National Cancer Institute. National Institutes of Health. 21 februari 2014. http://www.cancer.gov/cancertopics/pdq/treatment/pancreatic/HealthProfessional/page1/AllPages. Läst 24 november 2014.
- ^ [a b] Halfdanarson, T.R.; Rabe, K.G.; Rubin, J.; Petersen, G.M. (2008-10). ”Pancreatic neuroendocrine tumors (PNETs): incidence, prognosis and recent trend toward improved survival” (på engelska). Annals of Oncology 19 (10): sid. 1727–1733. doi:. https://linkinghub.elsevier.com/retrieve/pii/S0923753419401774. Läst 1 oktober 2023.
- ^ [a b] Konukiewitz, Björn; Jesinghaus, Moritz; Kasajima, Atsuko; Klöppel, Günter (2022-02). ”Neuroendocrine neoplasms of the pancreas: diagnosis and pitfalls” (på engelska). Virchows Archiv 480 (2): sid. 247–257. doi:. ISSN 0945-6317. https://link.springer.com/10.1007/s00428-021-03211-5. Läst 1 oktober 2023.
- ^ [a b] ”Pancreatic neuroendocrine tumors: A review of serum biomarkers, staging, and management.”. World J Gastroenterol. 2020 May 21;26(19):2305-2322.. https://www-ncbi-nlm-nih-gov.ezproxy.its.uu.se/pmc/articles/PMC7243647/. Läst 1 oktober 2023.
- ^ [a b] Nagtegaal, Iris D; Odze, Robert D; Klimstra, David; Paradis, Valerie; Rugge, Massimo; Schirmacher, Peter (2020-01). ”The 2019 WHO classification of tumours of the digestive system” (på engelska). Histopathology 76 (2): sid. 182–188. doi:. ISSN 0309-0167. PMID 31433515. PMC: PMC7003895. https://onlinelibrary.wiley.com/doi/10.1111/his.13975. Läst 1 oktober 2023.
- ^ Assarzadegan, Naziheh; Montgomery, Elizabeth (2021-06-01). ”What is New in the 2019 World Health Organization (WHO) Classification of Tumors of the Digestive System: Review of Selected Updates on Neuroendocrine Neoplasms, Appendiceal Tumors, and Molecular Testing” (på engelska). Archives of Pathology & Laboratory Medicine 145 (6): sid. 664–677. doi:. ISSN 1543-2165. https://meridian.allenpress.com/aplm/article/145/6/664/442277/What-is-New-in-the-2019-World-Health-Organization. Läst 1 oktober 2023.
- ^ Brierley, James D.; Gospodarowicz, Mary K.; Wittekind, Christian (2017-02-26). ”Gastrointestinal Tumours”. TNM Online: sid. 247–247. doi:. http://dx.doi.org/10.1002/9780471420194.tnmc77. Läst 1 oktober 2023.
- ^ Metz, David C.; Jensen, Robert T. (2008-11). ”Gastrointestinal Neuroendocrine Tumors: Pancreatic Endocrine Tumors” (på engelska). Gastroenterology 135 (5): sid. 1469–1492. doi:. https://linkinghub.elsevier.com/retrieve/pii/S0016508508008688. Läst 1 oktober 2023.
- ^ Svensson, Ellinor (2022). ”The incidence of insulinoma in Western Sweden between 2002 and 2019”. Annals of Gastroenterology. doi:. http://www.annalsgastro.gr/files/journals/1/earlyview/2022/ev-03-2022-06-AG_6567-0707.pdf. Läst 1 oktober 2023.
- ^ [a b] Okabayashi, Takehiro (2013). ”Diagnosis and management of insulinoma” (på engelska). World Journal of Gastroenterology 19 (6): sid. 829. doi:. ISSN 1007-9327. http://www.wjgnet.com/1007-9327/full/v19/i6/829.htm. Läst 1 oktober 2023.
- ^ Peltola, Elina; Hannula, Päivi; Huhtala, Heini; Metso, Saara; Sand, Juhani; Laukkarinen, Johanna (2021-10-01). ”Long-term morbidity and mortality in patients diagnosed with an insulinoma”. European Journal of Endocrinology 185 (4): sid. 577–586. doi:. ISSN 0804-4643. https://academic.oup.com/ejendo/article/185/4/577/6654364. Läst 1 oktober 2023.
- ^ Azizian, Azadeh; König, Alexander; Ghadimi, Michael (2022-08-05). ”Treatment options of metastatic and nonmetastatic VIPoma: a review” (på engelska). Langenbeck's Archives of Surgery 407 (7): sid. 2629–2636. doi:. ISSN 1435-2451. https://link.springer.com/10.1007/s00423-022-02620-7. Läst 1 oktober 2023.
- ^ ”Shibboleth Authentication Request”. login.ezproxy.its.uu.se. doi:. https://login.ezproxy.its.uu.se/login?qurl=https://doi.org%2f10.1046%2fj.1440-1827.2000.01016.x. Läst 1 oktober 2023.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Bukspottkörtelcancer.
Wikimedia Commons har media som rör Bukspottkörtelcancer.- ”Cancer i bukspottkörteln”. Cancerfonden. https://www.cancerfonden.se/om-cancer/cancersjukdomar/bukspottkortelcancer.
| |||||||||||||||||||
