Zink
| Zink | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
  Emissionsspektrum | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Generella egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Relativ atommassa | 65,409 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Utseende | Blåaktigt blekgrå | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fysikaliska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densitet | 7 140 kg/m³ (273 K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aggregationstillstånd | Fast | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältpunkt | 692,68 K (419,5 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kokpunkt | 1 180 K (907 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molvolym | 9,16 × 10-6 m³/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Smältvärme | 7,322 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ångbildningsvärme | 115,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomära egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomradie | 135 (142) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalent radie | 131 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| van der Waalsradie | 139 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jonisationspotential | Första: 906,4 kJ/mol Andra: 1 733,3 kJ/mol Tredje: 3 833 kJ/mol Fjärde: 5 731 kJ/mol (Lista) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronkonfiguration | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
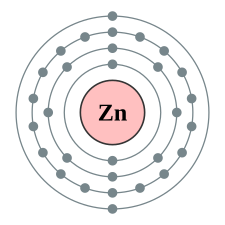
| Elektronkonfiguration | [Ar] 3d10 4s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| e− per skal | 2, 8, 18, 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kemiska egenskaper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxidationstillstånd | 2 (amfoterisk) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativitet | 1,65 (Paulingskalan) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Diverse | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristallstruktur | hexagonal (distorderad hcp) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ljudhastighet | 3 700 m/s | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrisk konduktivitet | 16,6 106 A/(V × m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohs hårdhet | 2,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Identifikation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Historia | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stabilaste isotoper | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsinformation | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Säkerhetsdatablad: Sigma-Aldrich | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| H-fraser | H250, H260, H410 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| P-fraser | P222, P210, P231+232, P280, P370+378, P273 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R-fraser | R15, R17, R50/53 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S-fraser | S(2), S43, S46, S60, S61 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SI-enheter och STP används om inget annat anges. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Zink är ett metalliskt grundämne med kemiskt tecken Zn och atomnummer 30. Även om zink har använts i koppar-zink-legeringen mässing ända sedan romerska rikets dagar och metallen i stor skala producerades i Indien runt år 1200, var den rena metallen okänd för Europa fram till slutet på 1500-talet. Den industriskaliga produktionen av zink i Europa kom inte igång förrän den senare delen av 1700-talet. Korrosionsbeständiga zinkbeläggningar på stål är ett viktigt användningsområde för metallen. Andra användningsområden är i batterier och legeringar, som exempelvis mässing. Zinkblände, en zinksulfid, är det viktigaste mineralet i zinkmalm. Zinkproduktion innefattar rostning, lakning och slutligen pyrometallurgisk vinning eller elektrovinning. Zink är ett vitalt mineralämne, nödvändigt för allt liv. Enzymer med en zinkatom i sitt reaktiva centrum är vitt spridda inom biokemin, exempelvis alkoholdehydrogenas hos människan. Konsumtion av för stora mängder zink kan leda till ataxi, trötthet och kopparbrist.
Historia
[redigera | redigera wikitext]Även om föremål av mässing är kända från sedan medeltid och ännu längre tillbaka, ibland med höga zinkhalter, var zinkmetall i stort sett okänd i västvärlden fram till 1500-talet, främst på grund av att metallen vid upphettning lätt förångas.
I antikens Grekland kände man till galmeja och använde det för mässingsframställning, Zinkoxid var känt under namnet "nix alba" och brukades som läkemedel.[4]
Metallen framställdes troligen första gången i Persien på 500-talet, förekom på 1200-talet i Indien och kort därefter i Kina. Under Mingdynastin tillverkades mynt av zink i Kina. Under 1500- och 1600-talet importerades Zink till Europa under namnet "Indiskt tenn". Georgius Agricola beskrev 1556 zink i De re metallica. Namnet Zink användes första gången av Paracelsus.[4]
Mässingslegeringar från Indien kallades tutanego, tuttanego, tuteneque eller spiauter. I Kina gick legeringen under namnet "packyyn". En av tutanegotackorna från Ostindiefararen Götheborg innehöll 99,0 procent zink, 0,8 procent järn och 0,2 procent antimon.[5]
I Europa hade små mängder zink framställts vid bergverken i Goslar sedan 1600-talet, men först på mitten av 1700-talet startades en större brytning. I Bristol anlades zinkhyttor 1743, och kort därefter inleddes produktionen i Schlesien och Belgien. Andreas Sigismund Marggraf lyckades 1746 framställa zink genom upphettning av galmeja och kol i en sluten retort. Detta hade tidigare lyckats även av Anton von Swab 1742, möjligen redan 1738.[4]
I Sverige anlades ett mässingsbruk 1571 i Vattholma, men först 1607 började man vid Skultuna bruk framställa egen svensk mässing. I mässingen legerades koppar med galmeja, först 1818 börjar man använda zink vid framställningen av mässing. Gruvbrytning av zink i större skala skedde första gången 1757 vid Stollbergs gruva.[4]
Biologisk betydelse
[redigera | redigera wikitext]Zink kan återfinnas i alla celler, men har en särskilt hög koncentration i ögon, hud, hår, naglar, hjärna, hypofys, binjurar, könsorgan, sköldkörtel, lever och njurar.
Fler än 70 enzymer är beroende av zink och klor, och nästan alla ämnesomsättningsprocesser är också det. Detsamma gäller hormonproduktionen i hypofysen, sköldkörteln, könsorganen och bukspottskörteln. Zink ingår i de enzymer som främjar transporten och utforslingen av koldioxid, och i amylas som omvandlar stärkelse. Vid syntesen av nukleinsyra (RNA och DNA) och proteiner medverkar zink aktivt. Det främjar nagel- och hårväxten, bildandet av ben och läkandet av sår (zinkpasta på munsår).
Immunförsvarets överordnade organ, thymus, är beroende av zink, samtidigt som ämnet är en beståndsdel i cellernas respirationsenzymer. Zink är dessutom en förutsättning för utnyttjandet av järn och bildandet av blod, normal funktion av prostata och optimalt utnyttjande av A-vitamin. Den kroppsvätska som har den högsta halten zink är prostatasekret, som kan ha upp mot 1000 gånger koncentrationen i blod. Prostatasekretets zink har betydelse för de ejakulerade spermiernas innehåll av zink i huvudet och därmed för skyddet av arvsmassan i spermien.
För högt zinkintag kan ge zinkförgiftning.[6]
Zinkbrist
[redigera | redigera wikitext]Vid brist på zink kan ett antal besvär uppstå. Här är några exempel:
- hudbesvär som eksem, akne, långsam läkning av sår[7][8]
- mentala tillstånd som apati, irritation, depression, aggression och dålig inlärningsförmåga[9]
- nedsatt smak- och luktförmåga,[10] ökad mottaglighet för infektioner[11]
Zink i födan
[redigera | redigera wikitext]Zink påträffas oftast i livsmedel som ostron, sill, musslor, lever, lamm, ägg, oxkött, mjölk, vetegroddar, fullkornsprodukter, vetekli, öljäst, nötter, ris, ärter, morötter, rödbetor, solrosfrö och kärnor från pumpan.
Animaliska livsmedel (kött, fågel och inälvsmat, samt mjölk och mjölkprodukter) och bröd utgör de största källorna till det dagliga intaget av zink. Dock hämmas upptaget om brödet innehåller fytinsyra.[12]
Rekommenderat dagligt intag: Barn 2–7 mg, kvinnor 7–9 mg (gravida/ammande 9/11 mg), män 9–12 mg. Se vidare RDI-tabell.
I Livsmedelsverkets senaste rikstäckande undersökning av kostvanor i den svenska befolkningen, Riksmaten - 2010-11, var det rapporterade intaget av zink per dag genom kosten i genomsnitt 9,5 mg för kvinnor, 12,4 mg för män och 10,8 mg för hela befolkningsgruppen i undersökningen.[13]
Användningsområden
[redigera | redigera wikitext]Zink har många viktiga användningsområden inom ytbehandling, särskilt galvanisering och varmförzinkning. Ett enkelt sätt att framställa vätgas är att utsätta zink för saltsyra enligt följande reaktion:
- Zn + 2HCl → ZnCl2 + H2
Elektrokemi
[redigera | redigera wikitext]
Med en elektrokemisk potential på -0,7628 volt är zink en bra metall för anodmaterial. Zink används som en del i batterier. Den vanligaste användningen i batterier är som anod (minuspol) i alkaliska batterier och det liknande brunstensbatteriet, i vilka oxidationen av zink är reaktionen vid anoden.[14][15]
Zink används som anod, eller bränsle, hos zink-luft-batterier/-bränsleceller. Zink används även som en offeranod på båtar och skepp som använder katodskydd för att förhindra korrosion hos de metaller som utsätts för havsvatten.[16]
Kistor
[redigera | redigera wikitext]Zink används i begravningskistor när den döde ska transporteras över landgränser.[17] Zink har bakteriedödande egenskaper, och det faktum att kistan är hermetiskt försluten gör att nedbrytningen av kroppen hämmas.
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från en annan språkversion av Wikipedia.
Noter
[redigera | redigera wikitext]- ^ Ur CLP-förordningen gällande CAS-Nr. 7440-66-6 i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung) (Kräver JavaScript) (ty, en).
- ^ Classification and Labelling Inventory, Europeiska kemikaliemyndigheten (ECHA), 1 augusti 2016.
- ^ [a b] Zink, Pulver oder Staub, nicht stabilisiert i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung). Läst 9. August 2016. (JavaScript krävs).
- ^ [a b c d] Nationalencyklopedin multimedia plus, 2000 (uppslagsord Zink)
- ^ Göteborgs sjöfartsmuseum om tutanego
- ^ Prasad, Ananda S (2003-02-22). ”Zinc deficiency”. BMJ : British Medical Journal 326 (7386): sid. 409–410. doi:. ISSN 0959-8138. PMID 12595353. PMC: 1125304. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1125304/. Läst 15 februari 2022.
- ^ Michaëlsson, G. (1981-02). ”Diet and acne”. Nutrition Reviews 39 (2): sid. 104–106. doi:. ISSN 0029-6643. PMID 6451820. https://pubmed.ncbi.nlm.nih.gov/6451820. Läst 15 februari 2022.
- ^ Kumar, Parveen (2012-06-04) (på engelska). Kumar and Clark's Clinical Medicine E-Book. Elsevier Health Sciences. ISBN 978-0-7020-5304-7. https://books.google.se/books?id=85Tgj1LBMjYC&redir_esc=y. Läst 15 februari 2022
- ^ (på engelska) Trace Elements in Human and Animal Nutrition: Volume 2. Elsevier. 2012-12-02. ISBN 978-0-08-092469-4. https://books.google.se/books?id=qA17FLN3OawC&q=zinc+hedonic+tone&pg=PA74&redir_esc=y#v=snippet&q=zinc%20hedonic%20tone&f=false. Läst 15 februari 2022
- ^ Stewart-Knox, Barbara J.; Simpson, Ellen E. A.; Parr, Heather; Rae, Gordon; Polito, Angela; Intorre, Federica (2008-01). ”Taste acuity in response to zinc supplementation in older Europeans”. The British Journal of Nutrition 99 (1): sid. 129–136. doi:. ISSN 0007-1145. PMID 17651517. https://pubmed.ncbi.nlm.nih.gov/17651517. Läst 15 februari 2022.
- ^ Lassi, Zohra S; Moin, Anoosh; Bhutta, Zulfiqar A (2016-12-04). ”Zinc supplementation for the prevention of pneumonia in children aged 2 months to 59 months”. The Cochrane Database of Systematic Reviews 2016 (12): sid. CD005978. doi:. ISSN 1469-493X. PMID 27915460. PMC: 6463931. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6463931/. Läst 15 februari 2022.
- ^ http://www.slv.se/sv/grupp1/Mat-och-naring/Vad-innehaller-maten/Salt--mineraler/Zink-/
- ^ Amcoff, Elisabet m.fl. (2012). Riksmaten - vuxna 2010-11 : Livsmedels- och näringsintag bland vuxna i Sverige. Uppsala: Livsmedelsverket. sid. 109. ISBN 978 91 7714 216 4. http://www.livsmedelsverket.se/globalassets/publikationsdatabas/rapporter/2011/riksmaten_2010_20111.pdf. Läst 4 augusti 2019
- ^ Besenhard, Jürgen O.. ”Handbook of Battery Materials” (PDF). http://www.ulb.tu-darmstadt.de/tocs/60178752.pdf. Läst 8 oktober 2008.
- ^ Wiaux, J. -P. (29 november 1995). ”Recycling zinc batteries: an economical challenge in consumer waste management”. Journal of Power Sources "57" (1–2): ss. 61–65. doi:. ISSN 0378-7753.
- ^ Bounoughaz, M.. ”A comparative study of the electrochemical behaviour of Algerian zinc and a zinc from a commercial sacrificial anode”. Journal of Materials Science "38" (6): ss. 1139–1145. doi:.
- ^ ”Begravningsförordning (1990:1147)”. Riksdagen. http://www.riksdagen.se/sv/Dokument-Lagar/Lagar/Svenskforfattningssamling/Begravningsforordning-199011_sfs-1990-1147/. Läst 20 september 2014.
Källor
[redigera | redigera wikitext]- Sven Rinman (29 november 1789). ”Zink”. Bergwerkslexikon. Arkiverad från originalet den 13 oktober 2007. https://web.archive.org/web/20071013145712/http://jernkontoret.se/bibliotek/urkunder_och_kallor/bergwerkslexicon/z.php. Läst 24 november 2007.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Zink.
Wikimedia Commons har media som rör Zink.- Historia & etymologi för zink
- Statistik och information från U.S. Geological Survey
- Reducing Agents > Zinc
- American Zinc Association Information om användningsområden och egenskaper hos zink.
|


