Chilesalpeter
| Natriumnitrat | |
 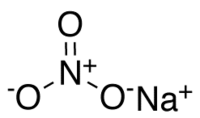 | |
| Systematiskt namn | Natriumnitrat |
|---|---|
| Övriga namn | Chilesalpeter, Natronsalpeter |
| Kemisk formel | NaNO3 |
| Molmassa | 84,9947 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 7631-99-4 |
| SMILES | [O-][N+](=O)[O-].[Na+] |
| Egenskaper | |
| Densitet | 2,257 g/cm³ |
| Löslighet (vatten) | 730 g/L 0°C
874 g/L 20°C 1800g/L 100°C väldigt lösligt i ammoniak och hydrazin |
| Smältpunkt | 308 °C |
| Kokpunkt | 380 °C (sönderfaller) |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 3236 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Chilesalpeter eller natronsalpeter är handelsnamnet för saltet natriumnitrat, kemisk formel NaNO3, som kan framställas genom att blanda natriumhydroxid med salpetersyra. Chilesalpeter kan även köpas i livsmedelsaffärer under handelsnamnet salpeter, vilket kan orsaka förvirring då den termen vanligen används för kaliumnitrat.
Natriumnitrat är syntetiserat industriellt av neutralisering av salpetersyra med natriumkarbonat eller natriumvätekarbonat:
Natriumnitrat är ett kristallint, färglöst, genomskinligt eller genomlysande salt. Det löses lätt i vatten, som därav erhåller en salt smak.
Förekomst
[redigera | redigera wikitext]Chilesalpeter förekommer naturligt i Tarapacá-området nära staden Iquique, på cirka 1000 meters höjd över havet på gränsen mellan Chile och Peru. Det återfinns där i metertjocka lager, i ett område med en utsträckning på 200–300 kvadratkilometer. Dessa stora salpeterlager med cirka 15 % renhet har uppkommit genom oxidation (förmultning) av kvävehaltiga, organiska ämnen, främst rester av havsdjur och dylikt. Då bildades salpetersyra, som tagit till sig en del av havsvattnets natronhalt.
Historik och användning
[redigera | redigera wikitext]I början av 1800-talet etablerade sig flera företag för att bryta natriumsalpeteter i Tarapacá-området i det som idag är norra Chile. Efterfrågan på krut var stor i Europa på grund av Napoleonkrigen. Normalt använde man kaliumnitrat vid tillverkningen, men natriumnitrat fungerade också. Det var dock sämre, eftersom natriumkrutet absorberar fukt och brinner långsammare. Det var först några decennier senare som utvinningen tog fart på allvar, när man upptäckt att natriumnitrat var ett utmärkt gödningsmedel. 1840 producerades 73 000 ton och 1870 500 000 ton. Dessutom blev jod en viktig biprodukt.[1]

Tarapacá låg i gränstrakten mellan Chile, Bolivia och Peru. De rika salpeterfyndigheterna ledde till väpnad konflikt mellan länderna, salpeterkriget 1879-1883. Kriget resulterade i gränsförändringar som ännu idag är omstridda. Framför allt förlorade Bolivia sin tillgång till Stillahavskusten. Efter kriget investerade främst brittiska företag stort i produktionen av chilesalpeter. Stora företagsstyrda samhällen bildades i öknen och salpeterskatten blev en viktig inkomstkälla för staten. Under decennierna runt sekelskiftet 1900 kom hälften av Chiles inkomster därifrån.[1]

1913 utvecklade tyskarna Fritz Haber och Carl Bosch ett kommersiellt gångbart sätt att syntetisera nitrat ur ammoniak, Haber-Boschmetoden. Det fick till följd att efterfrågan på chilesalpeter minskade. 1890 producerade Chile 80% av världens nitrat, 1950 15% och 1990 bara 0,1%.[1]
Natriumnitrat används av privatpersoner numera ofta för konservering och rimning av till exempel julskinka. Använt som konserveringsmedel betecknas chilesalpeter med E-nummer 251.
Natriumnitrat används även som fryspunktnedsättande tillsatsmedel i betong, mur- och putsbruk.
Se även
[redigera | redigera wikitext]Källor
[redigera | redigera wikitext]- ^ [a b c] Darlington, John (2023). ”Världen som salpeter byggde”. Människan och teknologin. Stockholm: Stolpe. sid. 43-50. ISBN 978-91-89425-87-3




