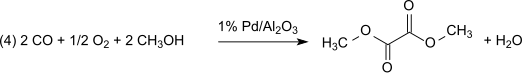Dimetyloxalat
| Dimetyloxalat | |
  | |
| Systematiskt namn | Dimetyloxalat |
|---|---|
| Kemisk formel | C4O4H6 eller (CH3)2C2O4 |
| Molmassa | 118,088 g/mol |
| Utseende | Vita eller färglösa kristaller |
| CAS-nummer | 553-90-2 |
| SMILES | COC(=O)C(=O)OC |
| Egenskaper | |
| Densitet | 1,148 g/cm³ |
| Löslighet (vatten) | 60 g/l (25 °C) |
| Smältpunkt | 53-55 °C |
| Kokpunkt | 166-167 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Dimetyloxalat är en dimetylester av metanol och oxalsyra med formeln (CH3)2C2O4.
Egenskaper
[redigera | redigera wikitext]Dimetyloxalat förekommer i ren form som vita kristaller eller flingor. Det är lösligt i alkohol och eter men hydrolyseras i varmt vatten.
Framställning
[redigera | redigera wikitext]Dimetyloxalat framställs genom att reagera metanol (CH3OH) och oxalsyra (C2O2(OH)2) med svavelsyra som katalysator.[1]
Oxidativ karbonyleringsväg
[redigera | redigera wikitext]Preparatet genom oxidativ karbonylering har väckt intresse eftersom det endast kräver C1-prekursorer:[2]
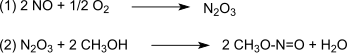
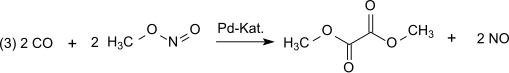
Reaktionen katalyseras av Pd2+.[3][4] Syntesgasen erhålls mestadels från kol eller biomassa. Oxidationen sker via dinitrogentrioxid, som enligt (1) bildas av kvävemonoxid och syre och sedan reagerar enligt (2) med metanol som bildar metylnitrit:[5]
I nästa steg av dikarbonylering (3) reagerar kolmonoxid med metylnitrit på dimetyloxalat i ångfasen vid atmosfärstryck och temperaturer vid 80-120 °C över en palladiumkatalysator:
Summaformel:
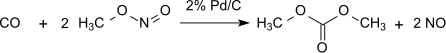
Denna metod är förlustfri med avseende på metylnitrit, som fungerar praktiskt som bärare av oxidationsekvivalenter. Det bildade vattnet måste emellertid avlägsnas för att förhindra hydrolys av dimetyloxalatprodukten. Med 1 procent Pd/α-Al2O3 produceras dimetyloxalat selektivt i en dikarbonyleringsreaktion och under samma betingelser med 2 procent Pd/C produceras dimetylkarbonat genom monokarbonylering:
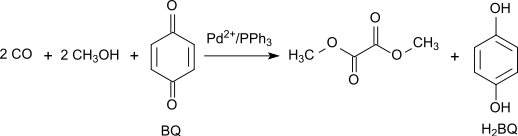
Alternativt kan den oxidativa karbonyleringen av metanol utföras med högt utbyte och selektivitet med 1,4-bensokinon som oxidant i systemet Pd(OAc)2/PPh3/bensokinon med massförhållandet 1/3/100 vid 65 °C och 70 atm CO:[4]
Användning
[redigera | redigera wikitext]Dimetyloxalat används som lösningsmedel och för tillverkning av läkemedel.
Dimetyloxalat (och den relaterade dietylestern) används i olika kondensationsreaktioner.[6] Till exempel kondenserar dietyloxalat med cyklohexanon för att ge diketoester, ett råämne till pimelinksyra.[7] Med diaminer kondenserar diestrarna av oxalsyra för att ge cykliska diamider. Quinoxalinedion framställs genom kondensation av dimetyloxalat och o-fenylendiamin:
- C2O2(OMe)2 + C6H4(NH2)2 → C6H4(NHCO)2 + 2 MeOH
Hydrogenering ger etylenglykol.[8] Dimetyloxalat kan omvandlas till etylenglykol med högt utbyte (94,7 procent).[9][10]
Den bildade metanolen återvinns i processen med oxidativ karbonylering.[11]
Dekarbonylering ger dimetylkarbonat.[12]
Difenyloxalat erhålls genom transesterifiering med fenol i närvaro av titankatalysatorer,[13] som återigen avkarboniseras till difenylkarbonat i vätske- eller gasfasen.
Dimetyloxalat kan också användas som metyleringsmedel. Det är särskilt mindre giftigt än andra metyleringsmedel som metyljodid eller dimetylsulfat.[14]
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Dimethyl oxalate, 30 oktober 2022.
Noter
[redigera | redigera wikitext]- ^ Everett Bowden (1930). ”Methyl Oxalate”. Organic Syntheses 10: sid. 78. doi:.
- ^ Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, S. 168; ISBN 978-3-527-31540-6.
- ^ US 4467109, Susumu Tahara et al., "Process for Continuous preparation of diester of oxalic acid", issued 1983-05-19, assigned to Ube Industries and EP 108359, K. Masunaga et al., "Process for the preparation of a diester of oxalic acid", assigned to Ube IndustriesEP 425197, K. Nishihira & K. Mizutare, "Process for preparing diester of carbonic acid", published 1991-05-2, assigned to Ube IndustriesUS 4451666, J.A. Sofranko, A.M. Gaffney, "Synthesis of oxalate esters by the oxidative carbonylation of alcohols", published 1984-05-29, assigned to Atlantic Richfield Co.
- ^ [a b] E. Amadio: Oxidative Carbonylation of Alkanols Catalyzed by Pd(II)-Phosphine Complexes, PhD Thesis, Ca’Foscari University Venice, 2009.
- ^ X.-Z. Jiang, Palladium Supported Catalysts in CO + RONO Reactions, Platinum Metals Rev., 1990, 34, (4), 178–180
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990). ”Alkylation with Oxalic Esters. Scope and mechanism”. Tetrahedron 46 (17): sid. 6113–6124. doi:.
- ^ H. R. Snyder, L. A. Brooks, S. H. Shapiro, A. Müller (1931). ”Pimelic Acid”. Organic Syntheses 11: sid. 42. doi:.
- ^ Nexant/Chemsystems, ”Coal to MEG, Changing the Rules of the Game”. Coal to MEG, Changing the Rules of the Game. Arkiverad från originalet den July 14, 2011. https://web.archive.org/web/20110714135349/http://www.chemsystems.com/reports/search/docs/prospectus/stmc10_coal_meg.pdf. Läst 8 augusti 2016. Arkiverad 14 juli 2011 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 14 juli 2011. https://web.archive.org/web/20110714135349/http://www.chemsystems.com/reports/search/docs/prospectus/stmc10_coal_meg.pdf. Läst 10 november 2022. (PDF; 5,4 MB), 2011 Prospectus
- ^ 983 EP 046 983, S. Tahara et al., "Process for continuously preparing ethylene glycol", assigned to Ube Industries and H. T. Teunissen and C. J. Elsevier, Ruthenium catalyzed hydrogenation of dimethyl oxalate to ethylene glycol, J. Chem. Soc., Chem. Commun., 1997, 667-668), DOI:10.1039/A700862G.
- ^ S. Zhang et al., Highly-Dispersed Copper-Based Catalysts from Cu–Zn–Al Layered Double Hydroxide Precursor for Gas-Phase Hydrogenation of Dimethyl Oxalate to Ethylene Glycol, Catalysis Letters, Sept. 2012, 142 (9), 1121–1127, DOI:10.1007/s10562-012-0871-8.
- ^ ”Individual news”. Individual news. http://www.icis.com/resources/news/2012/01/30/9527520/china-s-coal-based-chemicals-are-a-trade-off/.
- ^ US 4544507, P. Foley, "Production of carbonate diesters from oxalate diesters", assigned to Celanese Corp
- ^ US 5834614, K. Nishihira et al., "Process for producing diaryl carbonate", assigned to Ube Industries, Ltd. and X.B. Ma et al., Preparation of Diphenyl Oxalate from Transesterification of Dimethyl Oxalate with Phenol over TS-1 Catalyst, Chinese Chem. Lett., 14 (5), 461–464 (2003), DOI:10.1016/s0378-3820(03)00075-4.
- ^ Bergman, Jan; Norrby, Per-Ola; Sand, Peter (1990-01-01). ”Alkylation with Oxalic Esters. Scope and mechanism” (på engelska). Tetrahedron 46 (17): sid. 6113–6124. doi:. ISSN 0040-4020. https://www.sciencedirect.com/science/article/pii/S0040402001879333.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Dimetyloxalat.
Wikimedia Commons har media som rör Dimetyloxalat.