Salvinorin
Salvinoriner är en grupp av naturligt förekommande kemiska ämnen och deras strukturanaloger. Flera salvinoriner har renframställts från växten profetsalvia (Salvia divinorum) vilket förklarar ämnenas namn. Kemiskt sett är de både diterpener och furanolaktoner, alltså laktoner med en furangrupp.
Salvinorin A är en hallucinogen med dissociativ effekt.[1] Salvinorin A är en potent agonist för kappa-opioidreceptorer.[1]
| Namn | Strukturformel | R1 | R2 | Summaformel | Molmassa | CAS-nummer | PubChem |
|---|---|---|---|---|---|---|---|
| Salvinorin A |  |
–OCOCH3 | − | C23H28O8 | 432,46 g·mol−1 | 83729-01-5 | PubChem 128563 |
| Salvinorin B | –OH | − | C21H26O7 | 390,43 g·mol−1 | 92545-30-7 | PubChem 11440685 | |
| Salvinorin C |  |
–OCOCH3 | –OCOCH3 | C25H30O9 | 475,29 g·mol−1 | 385785-99-9 | – |
| Salvinorin D | –OCOCH3 | –OH | C23H28O8 | 432,47 g·mol−1 | 540770-13-6 | – | |
| Salvinorin E | –OH | –OCOCH3 | C23H28O8 | 432,47 g·mol−1 | 540770-14-7 | PubChem 11729714 | |
| Salvinorin F | –OH | –H | C21H26O6 | 374,43 g·mol−1 | 540770-15-8 | – | |
| Salvinorin G | =O | –OCOCH3 | C23H26O8 | 430,45 g·mol−1 | 866622-54-0 | – | |
| Salvinorin H | –OH | –OH | C21H26O7 | 390,43 g·mol−1 | 872004-62-1 | (Chemspider) | |
| Salvinorin I |  |
– | – | C21H28O7 | 392,45 g·mol−1 | 917951-71-4 | – |
| 17α-Salvinorin J | 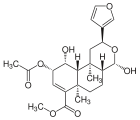 |
– | – | C23H30O8 | 434,49 g·mol−1 | 1157894-83-1 | – |
| 17β-Salvinorin J |  |
– | – | C23H30O8 | 434,49 g·mol−1 | 1157894-85-3 | – |
Liknande ämnen
[redigera | redigera wikitext]I jakt på ämnen med gynnsam biologisk aktivitet har olika syntetiska och semisyntetiska analoger framställts och studerats. Bland de semisyntetiska analogerna finns salvinorin B-etoximetyleter och salvinorin B-metoximetyleter.[2] Helsyntetiska analoger inkluderar herkinorin.[3][4]
Flera derivat kan framställas från salvinorin B.[5] De flesta derivat är, i likhet med salvinorin A, agonister för kappa-opioidreceptorer.[6][7] Derivatet 2-etoximetyl-salvinorin B har sju gånger starkare effekt på kappa-opioidreceptorer än salvinorin A,[5] och är ett av få derivat som har visats ha ännu starkare effekt än salvinorin A.[2] Vissa derivat av herkinorin, som är en my-opioidreceptoragonist, är svaga antagonister för my-opioidreceptorn.[4]
Flera andra terpenoider har extraherats ur Salvia divinorum, några har format grupperna divinatorin and salvinicin.[8][9] Inga av dessa ämnen har påvisats bidra till växtens psykoaktiva effekt.[8][9]
Källor
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Salvinorin, 17 augusti 2019.
- ^ [a b] MacLean, Katherine A.; Johnson, Matthew W.; Reissig, Chad J.; Prisinzano, Thomas E.; Griffiths, Roland R. (2013). ”Dose-related Effects of Salvinorin A in Humans: Dissociative, Hallucinogenic, and Memory Effects”. Psychopharmacology 226 (2): sid. 381–392. doi:. ISSN 0033-3158. PMID 23135605. PMC: 3581702. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3581702/. Läst 2 september 2019.
- ^ [a b] Munro TA; Duncan KK; Xu W; Wang Y; Liu-Chen LY; Carlezon WA; Cohen BM; Béguin C (2008). ”Standard protecting groups create potent and selective κ opioids: salvinorin B alkoxymethyl ethers”. Bioorganic & Medicinal Chemistry 16 (3): sid. 1279–86. doi:. PMID 17981041.
- ^ Tidgewell, Kevin; Harding, Wayne W.; Lozama, Anthony; Cobb, Howard; Shah, Kushal; Kannan, Pavitra (26 maj 2006). ”Synthesis of salvinorin A analogues as opioid receptor probes”. Journal of Natural Products 69 (6): sid. 914–918. doi:. ISSN 0163-3864. PMID 16792410. https://www.ncbi.nlm.nih.gov/pubmed/16792410. Läst 2 september 2019.
- ^ [a b] Holden KG; Tidgewell K; Marquam A; Rothman RB; Navarro H; Prisinzano TE (2007). ”Synthetic studies of neoclerodane diterpenes from Salvia divinorum: exploration of the 1-position”. Bioorganic & Medicinal Chemistry Letters 17 (22): sid. 6111–5. doi:. PMID 17904842.
- ^ [a b] Lee, David Y. W.; Karnati, Vishnu V. R.; He, Minsheng; Liu-Chen, Lee-Yuan; Kondaveti, Leelakrishna; Ma, Zhongze (15 augusti 2005). ”Synthesis and in vitro pharmacological studies of new C(2) modified salvinorin A analogues”. Bioorganic & Medicinal Chemistry Letters 15 (16): sid. 3744–3747. doi:. ISSN 0960-894X. PMID 15993589. https://www.ncbi.nlm.nih.gov/pubmed/15993589. Läst 2 september 2019.
- ^ Lee DY; He M; Liu-Chen LY; Wang Y; Li JG; Xu W; Ma Z; Carlezon WA; et al. (2006). ”Synthesis and in vitro pharmacological studies of new C(4)-modified salvinorin A analogues”. Bioorganic & Medicinal Chemistry Letters 16 (21): sid. 5498–502. doi:. PMID 16945525.
- ^ Béguin C; Richards MR; Li JG; Wang Y; Xu W; Liu-Chen LY; Carlezon WA; Cohen BM (2006). ”Synthesis and in vitro evaluation of salvinorin A analogues: effect of configuration at C(2) and substitution at C(18)”. Bioorganic & Medicinal Chemistry Letters 16 (17): sid. 4679–85. doi:. PMID 16777411.
- ^ [a b] Bigham AK; Munro TA; Rizzacasa MA; Robins-Browne RM (2003). ”Divinatorins A-C, new neoclerodane diterpenoids from the controlled sage Salvia divinorum”. Journal of Natural Products 66 (9): sid. 1242–4. doi:. PMID 14510607. https://citeseerx.ist.psu.edu/viewdoc/summary?doi=10.1.1.693.6690.
- ^ [a b] Munro TA; Rizzacasa MA (2003). ”Salvinorins D-F, new neoclerodane diterpenoids from Salvia divinorum, and an improved method for the isolation of salvinorin A”. Journal of Natural Products 66 (5): sid. 703–5. doi:. PMID 12762813.
