Normalpotential
Normalpotential är i elektrokemin den elektromotoriska kraften hos en galvanisk cell byggd av en standardreferenselektrod och en annan elektrod som ska karakteriseras.[1] Enligt konvention är referenselektroden standardväteelektroden (SHE). Den definieras till att ha en potential på noll volt. Det kan också definieras som potentialskillnaden mellan de laddade metallstavarna och saltlösningen.
Elektrodpotentialen har sitt ursprung i potentialskillnaden som utvecklas i gränsytan mellan elektroden och elektrolyten. Det är till exempel vanligt att tala om elektrodpotentialen för M+/M-redoxparet.
Ursprung och tolkning
[redigera | redigera wikitext]Elektrodpotential uppträder vid gränsytan mellan en elektrod och elektrolyt på grund av överföringen av laddade ämnen över gränsytan, specifik adsorption av joner vid gränsytan och specifik adsorption/orientering av polära molekyler, inklusive de av lösningsmedlet.
I en elektrokemisk cell har katoden och anoden oberoende en viss elektrodpotential och skillnaden mellan dem är cellpotentialen:
Elektrodpotentialen kan vara antingen den vid jämvikt vid arbetselektroden ("reversibel potential"), eller en potential med en nettoreaktion som inte är noll på arbetselektroden men noll nettoström ("korrosionspotential", "blandad potential"), eller en potential med en nettoström som inte är noll på arbetselektroden (som vid galvanisk korrosion eller voltammetri). Reversibla potentialer kan ibland omvandlas till standardelektrodpotentialen för en given elektroaktiv art genom extrapolering av de uppmätta värdena för standardtillståndet.
Värdet på elektrodpotentialen under ickejämvikt beror på naturen och sammansättningen av kontaktfaserna och på kinetiken för elektrodreaktioner vid gränssnittet (se Butler–Volmer-ekvationen).
Ett driftantagande för bestämning av elektrodpotentialerna med Standardväteelektroden innebär att denna referenselektrod med vätejon i en ideal lösning har "nollpotential vid alla temperaturer" motsvarande standardentalpi för bildning av vätejon är också "noll vid alla temperaturer".
Mått
[redigera | redigera wikitext]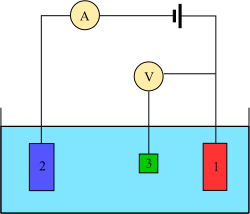
Mätningen utförs vanligtvis med en treelektroduppsättning (se ritningen):
- arbetselektrod,
- motelektrod,
- referenselektrod (standard väteelektrod eller motsvarande).
I händelse av ickenoll nettoström på elektroden är det viktigt att minimera det ohmska IR-fallet i elektrolyten, till exempel genom att placera referenselektroden nära ytan av arbetselektroden (till exempel se Luggin kapillär), eller genom att använda en stödjande elektrolyt med tillräckligt hög konduktivitet. Potentialmätningarna utförs med den positiva polen på elektrometern ansluten till arbetselektroden och den negativa polen till referenselektroden.
Konventioner
[redigera | redigera wikitext]Historiskt har två konventioner för tecken för elektrodpotentialen bildats: [2]
- konventionen "Nernst–Lewis–Latimer" (ibland kallad "amerikansk"),
- konventionen "Gibbs–Ostwald–Stockholm" (ibland kallad "europeisk").
IUPAC fastställde1953 i Stockholm[3] att var och en av konventionerna är tillåten, men rekommenderade dock enhälligt att endast den storlek som uttrycks enligt konventionen (2) kallas "elektrodpotentialen". För att undvika möjliga oklarheter kan den sålunda definierade elektrodpotentialen också hänvisas till som Gibbs–Stockholm elektrodpotential. I båda konventionerna är standardväteelektroden definierad att ha en potential på 0 V. Båda konventionerna överensstämmer också om tecknet på E för en halvcellsreaktion när det skrivs som en reduktion.
Huvudskillnaden mellan de två konventionerna[4] är att vid omkastning av riktningen för en halvcellsreaktion som skriven, enligt konventionen (1) växlar tecknet även för E, medan det i konventionen (2) inte gör det. Logiken bakom att byta tecken för E är att bibehålla det korrekta teckenförhållandet med Gibbs fria energiförändring, givet av ΔG=-nFE där n är antalet inblandade elektroner och F är Faradays konstant. Det antas att halvreaktionen balanseras av lämplig SHE-halvreaktion. Sedan ΔG byter tecken när en reaktion skrivs omvänt, så hävdar förespråkare av konventionen (1), att tecknet för E också gör det. Förespråkare av konventionen (2) hävdar att alla rapporterade elektrodpotentialer bör överensstämma med det elektrostatiska tecknet på den relativa potentialskillnaden.
Potentiell skillnad för en cell sammansatt av två elektroder
[redigera | redigera wikitext]Potentialen för en cell sammansatt av två elektroder kan bestämmas från de två individuella elektrodpotentialerna med hjälp av
eller på motsvarande sätt
Detta följer av IUPAC-definitionen av den elektriska potentialskillnaden för en galvanisk cell,[5] enligt vilken den elektriska potentialskillnaden för en cell är skillnaden mellan potentialerna för elektroderna till höger och vänster om den galvaniska cellen. När ΔV -cellen är positiv flödar positiv elektrisk laddning genom cellen från vänster elektrod (anod) till höger elektrod (katod).
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Electrode potential, 1 februari 2022.
Noter
[redigera | redigera wikitext]- ^ IUPAC, IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "electrode potential, E". doi:10.1351/goldbook.E01956
- ^ C.A. Hamel, "The Encyclopedia of Electrochemistry", Reinhold Publishing Corporation, New York-Chapman & Hall Ltd., London, 1964, p. 429–431.
- ^ P. van Rysselberghe, "Bericht der Kommission für electrochemische Nomenklatur und Definitionen", Z. Electrochem., 58 (1954), 530–535.
- ^ Anson, Fred C. "Common sources of confusion; Electrode Sign Conventions," J. Chem. Educ., 1959, 36, p. 394.
- ^ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "electric potential difference, ΔV of a galvanic cell". doi:10.1351/goldbook.E01934
Externa länkar
[redigera | redigera wikitext]



