Fluoroantimonisk syra
| Den här artikeln behöver källhänvisningar för att kunna verifieras. (2019-02) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |
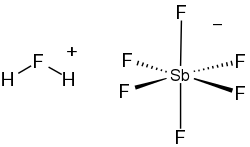

Fluoroantimonisk syra är en oorganisk förening med den kemiska formeln H2FSbF6 (också skrivet H2F[SbF6, 2HF·SbF5, eller HF-SbF5). Det är en jonisk vätska som framställs genom att vätefluorid (HF) blandas med antimonpentafluorid (SbF5) i ett stökiometriskt förhållande av 2:1. Det är den starkaste supersyran vi känner till.
Reaktionen för att producera fluoroantimonisk syra är:
- SbF5 + 2 HF → SbF−
6 + H2F+
Försiktighet
[redigera | redigera wikitext]Fluoroantimonisk syra är extremt starkt etsande, giftigt och fuktighetskänsligt. Som de flesta starka syror reagerar syran våldsamt med vatten i en exotermisk process. På grund av detta kan den inte användas i vattenlösning, utan löses hellre i vätefluorid. Den kan uteslutningsvis förvaras i teflonbehållare eftersom den mycket snabbt fräter sönder alla andra material, däribland glas.
