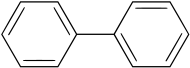
Difenyl
| Difenyl | |
  | |
| Systematiskt namn | Difenyl |
|---|---|
| Övriga namn | Bifenyl, Fenylbensen, Lemonen |
| Kemisk formel | C12H10 eller (C6H5)2 |
| Molmassa | 154,21 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 92-52-4 |
| SMILES | c1ccccc1(c2ccccc2) |
| Egenskaper | |
| Densitet | 0,992 g/cm³ |
| Löslighet (vatten) | Olöslig |
| Smältpunkt | 68,9 °C |
| Kokpunkt | 256 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 2 400 mg/kg (oralt, kanin) 3 280 mg/kg (oralt, råtta) 1 900 mg/kg (oralt, mus) 2 400 mg/kg (oralt, råtta)[1] |
| SI-enheter & STP används om ej annat angivits | |
Difenyl, bifenyl eller fenylbensen är ett aromatiskt kolväte som bildar färglösa kristaller. Särskilt i äldre litteratur kan föreningar som innehåller den funktionella gruppen bestående av bifenyl mindre ett väte (det ställe där det är fäst) använda prefixen xenyl eller difenylyl.[2]
Den har en distinkt trevlig lukt och kan noteras som ett utgångsmaterial för produktion av polyklorerade bifenyler (PCB), som en gång användes i stor utsträckning som dielektriska vätskor och värmetransportmedel.
Difenyl är också en mellanprodukt för produktion av en mängd andra organiska föreningar som emulgeringsmedel, optiska vitmedel, växtskyddsmedel och plast. Difenyl är olösligt i vatten, men lösligt i typiska organiska lösningsmedel.
Egenskaper
[redigera | redigera wikitext]Difenyl består av två fenylgrupper som på grund av den steriska effekten är låsta i 90° vinkel mot varandra. Det förekommer naturligt i stenkolstjära, råolja och naturgas och kan isoleras från dessa källor genom destillation.[3]
Framställning
[redigera | redigera wikitext]Difenyl produceras industriellt som en biprodukt av dealkylering av toluen för att producera metan:
Den andra huvudsakliga vägen går genom oxidativ dehydrogenering av bensen:
Årligen produceras 40 000 ton med dessa processer.[4]
I laboratoriet kan difenyl också syntetiseras genom att behandla fenylmagnesiumbromid med koppar(II)-salter.
Det kan också framställas av diazoniumsalter. När anilin behandlas med NaNO2+dil HCl vid 278 K ger det bensendiazoniumklorid. När detta reageras ytterligare med bensen bildas difenyl. Det är känt som Gomberg Bachmann-reaktion.
Användning
[redigera | redigera wikitext]Difenyl saknar funktionella grupper och är ganska ickereaktivt, vilket är grunden för dess huvudsakliga tillämpning. I laboratoriet används difenyl huvudsakligen som ett värmeöverföringsmedel som en eutektisk blandning med difenyleter. Denna blandning är stabil till 400 °C.
Difenyl genomgår sulfonering som, följt av bashydrolys, producerar p-hydroxidifenyl och p,p′-dihydroxibifenyl, som är användbara fungicider. I andra substitutionsreaktioner genomgår den halogenering. Polyklorerade bifenyler var en gång populära bekämpningsmedel.[4]
Litiumdifenyl innehåller den radikala anjonen, som är mycket reducerande (-3,1 V vs Fc+/0). Flera solvater av alkalimetallsalter av difenyanjon har karakteriserats genom röntgenkristallografi.[5] Dessa salter, vanligtvis framställda på plats, är mångsidiga reduktionsmedel.[6] Litiumdifenyl erbjuder vissa fördelar i förhållande till den relaterade litiumnaftenen.[7] Besläktat med Li/difenyl är derivatet med två tert-butylgrupper på difenylen.[8]
Difenyl används även som konserveringsmedel mot mögel, och har då E-nummer 230 (i kombination med E231, E232 och E233). Difenyl användes i Sverige fram till 1970 för att impregnera omslagspapper till citrusfrukter, så att inte frukten skulle mögla.
Stereokemi
[redigera | redigera wikitext]Rotation om enkelbindningen i difenyl, och särskilt dess ortosubstituerade derivat, hindras steriskt. Av denna anledning visar vissa substituerade difenyler atropisomerism, det vill säga de enskilda C2-symmetriska isomererna är optiskt stabila. Vissa derivat, liksom relaterade molekyler som BINAP, finner tillämpning som liganderiasymmetrisk syntes. När det gäller osubstituerad difenyl är jämviktstorsionsvinkeln 44,4° och torsionsbarriärerna är ganska små, 6,0 kJ/mol vid 0° och 6,5 kJ/mol vid 90°.[9] Genom att lägga till ortosubstituenter kan barriären kraftigt ökas. I fallet med 2,2'-dimetylderivatet är barriären 17,4 kcal/mol (72,8 kJ / mol).[10]
Biologiska aspekter
[redigera | redigera wikitext]Difenyl är milt giftigt, men kan brytas ned biologiskt genom omvandling till giftfria föreningar. Vissa bakterier kan hydroxylera difenyl och dess polyklorerade bifenyler (PCB).[11]
Det är en del av den aktiva gruppen i antibiotikumet oritavancin.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Biphenyl, 11 februari 2022.
- "Isolation and Identification of Biphenyls from West Edmond Crude Oil". N. G. Adams and D. M. Richardson. Analytical Chemistry 1953 25 (7), 1073–1074.
- Biphenyl (1,1-Biphenyl). Wiley/VCH, Weinheim (1991), ISBN 3-527-28277-7.
Noter
[redigera | redigera wikitext]- ^ ”Diphenyl”. Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH). 4 december 2014. https://www.cdc.gov/niosh/idlh/92524.html. Läst 17 mars 2015.
- ^ ”Beilsteins Handbuch der organischen Chemie, Volume 5”. https://archive.org/stream/beilsteinshandb01gesegoog/beilsteinshandb01gesegoog_djvu.txt.
- ^ Adams, N. G., and D. M. Richardson, 1953. Isolation and Identification of Biphenyls from West Edmond Crude Oil. Analytical Chemistry 25 (7): 1073-1074
- ^ [a b] Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer, Hartmut Höke "Hydrocarbons" in Ullmann's Encyclopedia of Industrial Chemistry 2002 Wiley-VCH, Weinheim. doi:10.1002/14356007.a13_227
- ^ Castillo, Maximiliano; Metta-Magaña, Alejandro J.; Fortier, Skye (2016). ”Isolation of gravimetrically quantifiable alkali metal arenides using 18-crown-6”. New Journal of Chemistry 40 (3): sid. 1923–1926. doi:.
- ^ Akira Yanagisawa, Katsutaka Yasue, Hisashi Yamamoto (1997). ”Regio- and Stereoselective Carboxylation of Allylic Barium Reagents: (E)-4,8-dimethyl-3,7-nonadienoic Acid”. Org. Synth. 74: sid. 178. doi:.
- ^ Rieke, Reuben D.; Wu, Tse-Chong; Rieke, Loretta I. (1995). ”Highly Reactive Calcium for the Preparation of Organocalcium Reagents: 1-Adamantyl Calcium Halides and Their Addition to Ketones: 1-(1-Adamantyl)cyclohexanol”. Org. Synth. 72: sid. 147. doi:.
- ^ Mudryk, Boguslaw; Cohen, Theodore (1995). ”1,3-Diols from Lithium β-Lithioalkoxides Generated by The Reductive Lithiation of Epoxides: 2,5-Dimethyl-2,4-hexanediol”. Org. Synth. 72: sid. 173. doi:.
- ^ Mikael P. Johansson and Jeppe Olsen (2008). ”Torsional Barriers and Equilibrium Angle of Biphenyl: Reconciling Theory with Experiment”. J. Chem. Theory Comput. 4 (9): sid. 1460–1471. doi:. PMID 26621432.
- ^ B. Testa (1982). ”The geometry of molecules: basic principles and nomenclatures”. i Christoph Tamm. Stereochemistry. Elsevier. sid. 18
- ^ ”Biphenyl degradation - Streptomyces coelicolor, at GenomeNet Database”. genome.jp. http://www.genome.jp/dbget-bin/show_pathway?sco00621+SCO6442.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Difenyl.
Wikimedia Commons har media som rör Difenyl.- CDC - NIOSH Pocket Guide to Chemical Hazards
- National Pollutant Inventory - Biphenyl
- External MSDS
| |||||||||||||||||||||||||||||||||||||
|




![{\displaystyle {\ce {Ph-NH2->[{\text{NaNO}}_{2}{\text{(aq), HCl}}][T{\text{=273-278K}}]Ph-N2+->[{\text{Ph-H, Δ}}]Ph-Ph}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e967b1efa92a4e8fedb8b83b1bae2c4666216da4)