Sfingolipid
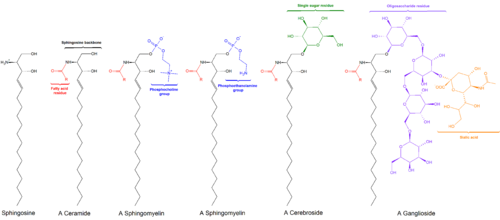
Sfingolipider är en klass av lipider som innehåller en ryggrad av sfingoida baser, som är en uppsättning alifatiska aminoalkoholer som innehåller sfingosin. De upptäcktes i hjärnextrakt på 1870-talet och fick namn efter den mytologiska sfinxen på grund av deras gåtfulla natur.[1][2] Dessa föreningar spelar viktiga roller i signaltransduktion och celligenkänning.[3] Sfingolipidoser, eller störningar av sfingolipidmetabolism, har särskild inverkan på neural vävnad. En sfingolipid med en terminal hydroxylgrupp är en ceramid. Andra vanliga grupper bundna till den terminala syreatomen inkluderar fosfokolin, vilket ger ett sfingomyelin, och olika sockermonomerer eller -dimerer, vilket ger cerebrosider respektive globosider. Cerebrosider och globosider är gemensamt kända som glykosfingolipider.
Struktur
[redigera | redigera wikitext]De långkedjiga baserna, ibland helt enkelt kända som sfingoida baser, är de första icke-övergående produkterna av de novo sfingolipidsyntes i både jäst och däggdjur. Dessa föreningar, specifikt kända som fytosfingosin och dihydrosfingosin (även känd som sfinganin,[4] även om denna term är mindre vanlig), är huvudsakligen C18-föreningar, med något lägre nivåer av C20-baser.[5] Ceramider och glykosfingolipider är N-acylderivat av dessa föreningar.[6]
Sfingosinryggraden är O-bunden till en (vanligtvis) laddad huvudgrupp som etanolamin, serin eller kolin. Ryggraden är också amidbunden till en acylgrupp, som en fettsyra.
Typer
[redigera | redigera wikitext]Enkla sfingolipider, som innehåller sfingoida baser och ceramider, utgör de tidiga produkterna av sfingolipidernas syntetiska vägar.
- Sfingoida baser är de grundläggande byggstenarna i alla sfingolipider. De huvudsakliga däggdjurssfingosinbaserna är dihydrosfingosin och sfingosin, medan dihydrosfingosin och fytosfingosin är de huvudsakliga sfingosinbaserna i jäst.[7][8] Sfingosin, dihydrosfingosin och fytosfingosin kan vara fosforylerade.
- Ceramider, som en allmän klass, är N -acylerade sfingoida baser som saknar ytterligare huvudgrupper.
- Dihydroceramid framställs genom N-acylering av dihydrosfingosin. Dihydroceramid finns i både jäst- och däggdjurssystem.
- Ceramid produceras i däggdjurssystem genom desaturation av dihydroceramid med dihydroceramiddesaturas 1 (DES1). Denna mycket bioaktiva molekyl kan också fosforyleras för att bilda ceramid-1-fosfat.
- Fytoceramid produceras i jäst genom hydroxylering av dihydroceramid vid C-4.
Komplexa sfingolipider kan bildas genom tillsats av huvudgrupper till ceramid eller fytoceramid:
- Sfingomyeliner har en fosfokolin- eller fosfoetanolaminmolekyl med en esterbindning till 1-hydroxigruppen i en ceramid.
- Glykosfingolipider är ceramider med en eller flera sockerrester sammanfogade i en β-glykosidbindning vid 1-hydroxylpositionen (se bild).
- Cerebrosider har en enda glukos eller galaktos i 1-hydroxipositionen.
- Sulfatider är sulfaterade cerebrosider.
- Cerebrosider har en enda glukos eller galaktos i 1-hydroxipositionen.
- Gangliosider har minst tre sockerarter, varav en måste vara sialinsyra.
- Inositol -innehållande ceramider, som härrör från fytoceramid, produceras i jäst. Dessa omfattar inositolfosforylceramid, mannosinositolfosforylceramid och mannosdiinositolfosforylceramid.
Däggdjurs sfingolipidmetabolim
[redigera | redigera wikitext]De novo sfingolipidsyntesen börjar med bildning av 3-keto-dihydrosfingosin av serinpalmitoyltransferas.[9] De föredragna substraten för denna reaktion är palmitoyl-CoA och serin. Studier har dock visat att serinpalmitoyltransferas har viss aktivitet mot andra arter av fettacyl-CoA[10] och alternativa aminosyror,[11] och mångfalden av sfingoida baser har nyligen granskats.[12] Därefter reduceras 3-keto-dihydrosfingosin för att bilda dihydrosfingosin. Dihydrosfingosin acyleras av en av sex (dihydro)-ceramidsyntaser, CerS - ursprungligen kallad LASS - för att bilda dihydroceramid.[13] De sex CerS-enzymerna har olika specificitet för acyl-CoA-substrat, vilket resulterar i generering av dihydroceramider med olika kedjelängder (som sträcker sig från C14-C26). Dihydroceramider avmättas sedan för att bilda ceramid.[14]
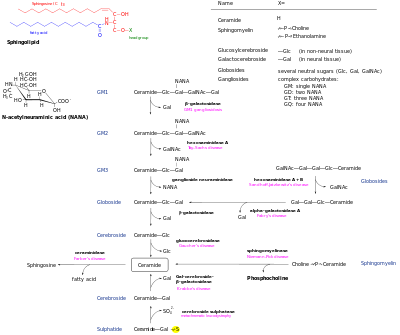
De novo-genererad ceramid är det centrala navet i sfingolipidnätverket och har sedan flera öden. Det kan fosforyleras av ceramidkinas för att bilda ceramid-1-fosfat. Alternativt kan den glykosyleras med glukosylceramidsyntas eller galaktosylceramidsyntas. Dessutom kan det omvandlas till sfingomyelin genom tillsats av en fosforylkolinhuvudgrupp genom sfingomyelinsyntas. Diacylglycerol genereras av denna process. Slutligen kan ceramid brytas ned av ett ceramidas för att bilda sfingosin. Sfingosin kan fosforyleras för att bilda sfingosin-1-fosfat. Detta kan defosforyleras för att reformera sfingosin.[15]
Nedbrytningsvägar möjliggör återgång av dessa metaboliter till ceramid. De komplexa glykosfingolipiderna hydrolyseras till glukosylceramid och galaktosylceramid. Dessa lipider hydrolyseras sedan av beta-glukosidaser och beta-galaktosidaser för att regenerera ceramid. På liknande sätt kan sfingomyelin brytas ned av sfingomyelinas för att bilda ceramid. Den enda vägen genom vilken sfingolipider omvandlas till icke-sfingolipider är genom sfingosin-1-fosfatlyas. Detta bildar etanolaminfosfat och hexadecenal.[16]
Däggdjurssfingolipiders funktioner
[redigera | redigera wikitext]Sfingolipider anses allmänt skydda cellytan mot skadliga miljöfaktorer genom att bilda en mekaniskt stabil och kemiskt resistent yttre omslutning av plasmamembranets lipiddubbelskikt. Vissa komplexa glykosfingolipider har visat sig medverka i specifika funktioner, såsom celligenkänning och signalering. Celligenkänning beror huvudsakligen på de fysikaliska egenskaperna hos sfingolipiderna, medan signalering utnyttjar specifika interaktioner mellan glykanstrukturerna hos glykosfingolipider med liknande lipider som finns på närliggande celler eller med proteiner.
Nyligen har enkla sfingolipidmetaboliter, som ceramid och sfingosin-1-fosfat, visat sig vara viktiga mediatorer i signalkaskaderna involverade i apoptos, proliferation, stressrespons, nekros, inflammation, autofagi, senescens och differentiering.[17][18][19][20][21] Ceramidbaserade lipider självaggregerar i cellmembran och bildar separata faser mindre flödiga än bulkfosfolipiderna. Dessa sfingolipidbaserade mikrodomäner, eller "lipidflottar" föreslogs ursprungligen att sortera membranproteiner längs de cellulära vägarna för membrantransport.[22]
Sfingolipider syntetiseras i en väg som börjar i ER och slutförs i Golgiapparaten, men dessa lipider anrikas i plasmamembranet och i endosomerna, där de utför många av dess funktioner.[23] Transport sker via vesikler och monomer transport i cytosolen. Sfingolipider är praktiskt taget frånvarande från mitokondrier och ER, men utgör en 20-35 molar fraktion av plasmamembranlipider.[24]
Hos försöksdjur hämmar utfodring med sfingolipider koloncarcinogenes, sänker LDL-kolesterol och höjer HDL-kolesterol.[25]
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Sfingolipid, 12 mars 2024.
Noter
[redigera | redigera wikitext]- ^ ”Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis”. Clinical Neuropharmacology 33 (2): sid. 91–101. 2010. doi:. PMID 20061941.
- ^ Schnaar, Ronald L.; Sandhoff, Roger; Tiemeyer, Michael; Kinoshita, Taroh (2022), Varki, Ajit; Cummings, Richard D.; Esko, Jeffrey D. m.fl., red., ”Glycosphingolipids”, Essentials of Glycobiology (Cold Spring Harbor (NY): Cold Spring Harbor Laboratory Press), ISBN 978-1-62182-421-3, PMID 35536927, https://www.ncbi.nlm.nih.gov/books/NBK579905/, läst 10 september 2024
- ^ Harayama, Takeshi; Riezman, Howard (May 2018). ”Understanding the diversity of membrane lipid composition”. Nature Reviews. Molecular Cell Biology 19 (5): sid. 281–296. doi:. ISSN 1471-0080. PMID 29410529. https://pubmed.ncbi.nlm.nih.gov/29410529/.
- ^ |SIGMA&N5=SEARCH_CONCAT_PNO|BRAND_KEY&F=SPEC Product page at Sigma Aldrich
- ^ ”Sphingolipid functions in Saccharomyces cerevisiae: comparison to mammals”. Annual Review of Biochemistry 67: sid. 27–48. 1998. doi:. PMID 9759481.
- ^ A brief, very comprehensible review is given in Gunstone, F. (1996) Fatty Acid and Lipid Chemistry, pp 43-44. Blackie Academic and Professional. ISBN 0-7514-0253-2
- ^ ”Thematic review series: sphingolipids. New insights into sphingolipid metabolism and function in budding yeast”. Journal of Lipid Research 49 (5): sid. 909–21. May 2008. doi:. PMID 18296751.
- ^ ”Bioactive sphingolipids: metabolism and function”. Journal of Lipid Research 50 Suppl (Suppl): sid. S91-6. April 2009. doi:. PMID 19017611.
- ^ ”Characterization of serine palmitoyltransferase activity in Chinese hamster ovary cells”. Biochimica et Biophysica Acta (BBA) - Lipids and Lipid Metabolism 754 (3): sid. 284–91. December 1983. doi:. PMID 6652105.
- ^ ”Utilization of different fatty acyl-CoA thioesters by serine palmitoyltransferase from rat brain”. Journal of Lipid Research 25 (2): sid. 185–8. February 1984. doi:. PMID 6707526. http://www.jlr.org/cgi/pmidlookup?view=long&pmid=6707526. Arkiverad 22 juli 2020 hämtat från the Wayback Machine.
- ^ ”Ceramide synthase inhibition by fumonisin B1 causes accumulation of 1-deoxysphinganine: a novel category of bioactive 1-deoxysphingoid bases and 1-deoxydihydroceramides biosynthesized by mammalian cell lines and animals”. The Journal of Biological Chemistry 284 (8): sid. 4786–95. February 2009. doi:. PMID 19095642.
- ^ ”Biodiversity of sphingoid bases ("sphingosines") and related amino alcohols”. Journal of Lipid Research 49 (8): sid. 1621–39. August 2008. doi:. PMID 18499644.
- ^ ”When do Lasses (longevity assurance genes) become CerS (ceramide synthases)?: Insights into the regulation of ceramide synthesis”. The Journal of Biological Chemistry 281 (35): sid. 25001–5. September 2006. doi:. PMID 16793762.
- ^ ”Further characterization of rat dihydroceramide desaturase: tissue distribution, subcellular localization, and substrate specificity”. Lipids 35 (10): sid. 1117–25. October 2000. doi:. PMID 11104018.
- ^ ”Principles of bioactive lipid signalling: lessons from sphingolipids”. Nature Reviews Molecular Cell Biology 9 (2): sid. 139–50. February 2008. doi:. PMID 18216770.
- ^ ”Sphingosine-1-phosphate lyase in immunity and cancer: silencing the siren”. Trends in Molecular Medicine 13 (5): sid. 210–7. May 2007. doi:. PMID 17416206.
- ^ ”The Ceramide-centric universe of lipid-mediated cell regulation: stress encounters of the lipid kind”. The Journal of Biological Chemistry 277 (29): sid. 25847–50. July 2002. doi:. PMID 12011103.
- ^ ”Sphingosine 1-phosphate, a key cell signaling molecule”. The Journal of Biological Chemistry 277 (29): sid. 25851–4. July 2002. doi:. PMID 12011102.
- ^ ”Regulation of autophagy by sphingosine kinase 1 and its role in cell survival during nutrient starvation”. The Journal of Biological Chemistry 281 (13): sid. 8518–27. March 2006. doi:. PMID 16415355. http://www.hal.inserm.fr/inserm-00172245.
- ^ ”Role of ceramide in cellular senescence”. The Journal of Biological Chemistry 270 (51): sid. 30701–8. December 1995. doi:. PMID 8530509.
- ^ ”Sphingosine kinase: Role in regulation of bioactive sphingolipid mediators in inflammation”. Biochimie 92 (6): sid. 707–15. June 2010. doi:. PMID 20156522.
- ^ ”Structure and function of sphingolipid- and cholesterol-rich membrane rafts”. The Journal of Biological Chemistry 275 (23): sid. 17221–4. June 2000. doi:. PMID 10770957.
- ^ ”Intracellular trafficking of sphingolipids: relationship to biosynthesis”. Biochimica et Biophysica Acta (BBA) - Biomembranes 1758 (12): sid. 1885–92. December 2006. doi:. PMID 16996025.
- ^ ”Sphingolipid transport: rafts and translocators”. The Journal of Biological Chemistry 277 (29): sid. 25855–8. July 2002. doi:. PMID 12011105.
- ^ ”Sphingolipids in food and the emerging importance of sphingolipids to nutrition”. The Journal of Nutrition 129 (7): sid. 1239–50. July 1999. doi:. PMID 10395583.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Sfingolipid.
Wikimedia Commons har media som rör Sfingolipid.- Laurila, Pirkka-Pekka (December 2022). ”Sphingolipids accumulate in aged muscle, and their reduction counteracts sarcopenia” (på engelska). Nature Aging 2 (12): sid. 1159–1175. doi:. ISSN 2662-8465. PMID 37118545. https://www.nature.com/articles/s43587-022-00309-6.
|
