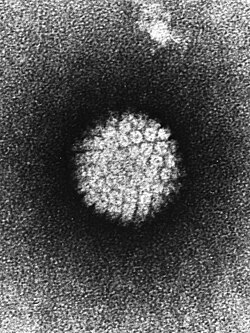
Papillomvirus
Papillomvirus (ibland papillomavirus)[1] är en mångfaldig familj av så kallade nakna och parasiterande dubbelsträngade DNA-virus vars värdar sträcker sig från fåglar och reptiler till däggdjur och människor.[2] Virusen klassificeras baserat på värdart, vävnadsspecificitet, histologi och gensekvens. Papillomvirus som infekterar människor kallas humant papillomvirus (HPV).[3]
Virusfamiljens evolutionära framgång och stora variation kopplas till en för virusen lyckad samevolution med sina värdar. Varje typ av papillomvirus är generellt sett artspecifik och dessutom ofta vävnadsspecifik, vilket innebär att typerna har evolutionära nischer där risken för konkurrens minskas. Virusen lyckats hålla sig ”före” sina värdar eftersom de molekylärt evolverar snabbare än sin värdart.[4]
Papillomvirus infekterar olika typer av epitelceller och kan orsaka vårtor eller benigna tumörer. De kan även ligga latenta i värdceller utan att orsaka symtom.[2] Vissa typer av papillomvirus klassificeras däremot som högrisktyper och kan orsaka cancer, exempelvis humant papillomvirus av typ 16 och 18.[5]
Taxonomi
[redigera | redigera wikitext]Papillomaviridae-familjen omfattar 53 släkten som delas in i två underfamiljer: Firstpapillomavirinae och Secondpapillomavirinae. Det som ytterst skiljer släktena är faktorer som olikheter inom genomen, värdorganismer, vävnadspecificitet och histologi.[3]
Papillomvirus som tillhör underfamiljen Firstpapillomavirinae har amnioter som värdar. Virus inom underfamiljen har koden för de väsentliga virala proteinerna (E1, E2, L1 och L2) samt minst ett accessoriskt protein (E5, E6 eller E7) i sin arvsmassa.[6]
Underfamiljen Secondpapillomavirinae har endast ett beskrivet virus och har isolerats hos en fisk. Det är det minsta papillomviruset, och arvsmassan består endast av de väsentliga virala proteinerna (E1, E2, L1 och L2).[6]
De första papillomvirusen som beskrevs hittades hos däggdjur (framför allt hos kaniner, nötkreatur och i vårtor hos människa). Virusen fick sina engelska namn efter sin värdart: exempelvis cottontail rabbit papillomavirus (CRPV), bovine papillomavirus (BVP) och human papillomavirus (HPV). Vid upptäckter av fler typer av viruset hos en och samma art adderades ett nummer efter dess namn och förkortning: exempelvis human papillomavirus 1 (HPV1).[7]
Humant papillomvirus
[redigera | redigera wikitext]Humant papillomvirus, HPV, är en smittsam virusinfektion som överförs sexuellt från en individ till en annan vid sexuella kontakter. Cirka 70 procent av män och kvinnor av den vuxna populationen i världen är smittade med HPV-infektioner. HPV finns i många typer, man har identifierat nära 200 HPV-typer som infekterar människor. Till exempel kan HPV-infektioner drabba epitelcellerna i öppningen av urinvägarna som ombildas till cancerceller i livmoderhalsen, vilket kan resultera i livmoderhalscancer. 90 procent av alla cervixcancerfall tros vara orsakade av HPV-infektioner, och HPV kan även orsaka andra cancerformer i tonsiller, vulva, vagina, anus och penisen.[8]
Papillomvirus och cancer hos människor
[redigera | redigera wikitext]De flesta HPV-infektioner orsakar en mild sjukdom eller helt symptomfria infektioner. Cancer räknas inte som ett typiskt resultat av infektion av papillomvirus, utan förekommer endast sällsynt och då med specifika typer av papillomvirus. Hos människan är humant papillomvirus (HPV) 6 och 11 förknippade med cancerrisk. Båda dessa virus kännetecknas av genitala infektioner i form av vårtor. Från infektion kan de ligga vilande i många år i hud eller slemhinna innan de aktiveras och då leda till genitala vårtor eller cervixdysplasi (en form av pre-cancer i livmodern orsakad av okontrollerad celltillväxt). Vissa HPV-typer har onkogen potential (kan orsaka cancer) som HPV-16 och HPV-18 vilka båda är förknippade med cancer i livmoderhalsen.[9]
Utvecklingen av cancerogen papillomvirusinfektion tar vanligtvis flera år. Papillomvirus har associerats med utveckling av olika cancerformer såsom cervixcancer, peniscancer och oral cancer.[10]

Livmoderhalscancer
[redigera | redigera wikitext]Humant papillomvirus HPV är en viktig orsak till utveckling av livmoderhalscancer, då infektion i sällsynta fall kan leda till onormal celltillväxt och cancer, ibland även med förmågan att metastasera sig till andra delar av kroppen. HPV16 och HPV18 utgör tillsammans cirka 70 procent av fallen av HPV-inducerad cancer och HPV31 och HPV41 utgör cirka 10 procent av fallen; resterande 20 procent orsakas av andra HPV-typer. De flesta HPV-infektionerna botas och självläker, men vissa har en persisterande förmåga som kan resultera i dysplasi och utvecklas till cancer genom inducering av onkogena transformationer där de inaktiverar tumörsuppressorgener.[11]
Kondylom och peniscancer
[redigera | redigera wikitext]Kondylom är en smittsam könssjukdom som orsakas av humant papillomvirus. Den kallas även för genital papillomvirusinfektion och är den vanligaste typen av sexuellt överförbara sjukdomar. Kondylom kan orsakas av många olika HPV-typer och symptomen varierar i intensitet och i varaktighet. Även om orsaken till peniscancer fortfarande är okänd finns en koppling med HPV: att bära HPV ökar risken att man drabbas av cancer, särskilt om man smittats med de virus som orsakar könsvårtor.[12] Generellt, om man bär på HPV-högrisktyperna (HPV-16,18,31,59 och 66) och samtidigt är smittad med kondylom, då ökar risken att infektionen utvecklas till cancer.[13]
Oral cancer
[redigera | redigera wikitext]Oral cancer, även känd som muncancer, drabbar munhålan och svalget. HPV kan infektera munhålan och svalget vilket i sin tur kan leda till orofarynxcancer (bakdelen av svalget samt tungbasen och halsmandlarna/tonsiller). Den här typen av cancer kallas för orofaryngeal cancer. Cirka 80 procent av orofaryngeal cancer i Sverige tros bero på HPV-infektion. I likhet med cancer i könsdelarna är det främst HPV-16 och 18 som är förknippade med förhöjd cancerrisk i mun-halsregionen. Orofarynxcancer ökar i förekomst och en orsak som föreslagits är ändrade sexualvanor. Tidigare har det rapporterats att risken för HPV-infektion ökar och blir allt mer riskabel hos personer med flera sexpartners under en period, vilket ökar risken att drabbas av orofarynxcancer, särskilt hos unga män vid sexdebut och vid mer än 5 sexpartners.[14]
Animala papillomvirus
[redigera | redigera wikitext]Papillomvirus är generellt artspecifika, men släktet har ett brett värdspektrum och har identifierats hos flera arter av ryggradsdjur, fåglar och reptiler. Störst fokus från forskningen har legat på humana papillomvirus och 193 olika HPV-typer som infekterar människor har beskrivits att jämföras med 183 virus från andra djurarter. Introduktionen av nya metoder för amplifiering och analys av viralt DNA har lett till att antalet kategoriserade varianter av animala papillomvirus ökat drastiskt.[15][16][17]
Bovine papillomvirus – BPV
[redigera | redigera wikitext]
Det finns för närvarande 23 olika typer av Bovine papillomvirus (BPV) beskrivna från klövdjur.[18] Baserat på genetiskt släktskap klassificeras de i fyra grupper. BPV utvecklar oftast godartade tumörer och orsakar inga medicinska komplikationer för värdarten. Dock kan BPV orsaka hyperplastiska hudflikar och papillom på slemhinnor, vilka kan vara potentiella kooperativa faktorer till cancer i matspjälkningskanalen och urinblåsan En studie som undersökt BPV-typer hos mjölkkor i Turkiet fann att i 35 BPV-positiva prover kunde BPV -1, -2, -3, -4, -6, -7, -9, och -10 identifieras. Tillika kunde nya förmodade typer av BPV upptäckas i proverna och möjligen kooperativa infektioner mellan de olika typerna, det antagandet behövdes styrkas med typspecifika primers. Studien har använt sig av PCR-analyser (Polymeraskedjereaktion) som ökar mängden av en viss DNA-sekvens hos viruset.[19] Det innebär att flera typer av BPV kan infektera en och samma värdart. BPV-viruset kan också infektera hästdjur och ge upphov till fibroplastiska tumörer (sarkoider).[18][20]
Exempel på papillomvirus hos djur
[redigera | redigera wikitext]| Taxonomi | Värdart | Papillomvirus | Förkortning | Klassifikation |
|---|---|---|---|---|
| Artiodactyla | Europeisk älg - Alces alces | Alces Alces | AaPV1 | Deltapapillomvirus |
| Carnivora | Golden retriver - Canis canis | Canis familiaris | CPV2 (CfPV2) | Taupapillomvirus |
| Carnivora | Shar pei - Canis lupus | Canis familiaris oral | CPV1 (COPV) | Lambdapapillomvirus |
| Cetacea | Sadeldelfin - Delphinus delphis | Delphinus delphis | DdPV1 | Upisilonpapillomvirus |
| Erinacemorpha | Europeisk igelkott - Erinaceus europaeus | Erinaceus europaeus | EePV1 | Dyoetapapillomvirus |
| Psittaciformes | Afrikansk grå jako - Psittacus erithacus | Psittacus erithacus | PePV1 | Thetapapillomvirus |
| Squamata | Rutpyton - Morelia spilota spilota | Morelia spilota | MsPV1 | Dyomupapillomvirus |
Evolution
[redigera | redigera wikitext]Papillomvirusen är generellt artspecifika då spridningsvägen ofta sker via sexuella kontakter, vilket innebär att spridningen inte förekommer mellan arter. Det har inneburit att papillomvirus har samevolverat med sin värdart och följt med sin värdart vid artbildning. Dock råder det delade meningar kring spridningen, då vissa studier tyder på att överföringar av viruset sker mellan arter.[21]
Oavsett har papillomviruset evolverat framgångsrikt genom många olika mekanismer, vilka har påverkat virusets omfattande fylogenetiska träd. Genom att papillomviruset har utvecklat flera ekologiska nischer för värdarter har de kunnat evolvera, dessutom har samevolution, adaptiv radiering och rekombination[förtydliga] varit avgörande faktorer för papillomfamiljens historiska utveckling.[4]
Evolution HPV58
[redigera | redigera wikitext]I östra Asien finns det HPV-58 typer som orsakar livmoderhalscancer, de typerna är ovanliga i resten av världen. 747 varianter av HPV-58 är kända och av dessa är A1, A2, och A3 vanligast i Asien medan i Europa och Amerika domineras bilden av A2 och andra varianter än A.Om man med hjälp av fylogeni analyserar evolutionen av HPV-58 ser man att den första delningen ägde rum för cirka 478 600 år sedan. Den tidsperioden överensstämmer med artbildningen mellan homo sapiens, neandertalare och denisova. Neandertalarna kan ha burit på en tidig variant av HPV vid migrationen från Afrika. Neandertalarna levde i Europa och västra Asien och där de kommit i kontakt med moderna människan i mellanöstern. Korsning mellan parterna har medfört sexuell överföring av virus. Dagens geografiska skillnader i HPV58-förekomster hos befolkningen kan då vara ett resultat av en tidig spridning av HPV-58. I och med att papillomvirus infekterar basal lamina i epitelceller är det omöjligt att studera virus från fossil från förfäder av homininer.[22]
Struktur
[redigera | redigera wikitext]Papillomvirus är ett cirkulärt dubbelsträngat DNA-virus med en ikosaeder-formad proteinkapsel. Proteinkapseln innehåller en kopia av arvsmassan som är sammanpackad med associerade histonproteiner.[6] Proteinkapseln saknar lipidmembran och papillomviruset kategoriseras därför som ett naket virus. Proteinkapseln har en diameter på 55 nm,[23] där utsidan av proteinkapseln består av 360 kopior av proteinet L1 format i 72 pentamerer bundet med 72 stycken L2-proteiner på insidan av kapseln.[24] Papillomvirus har en genomsnittlig genomstorlek om 7500 stycken baspar.[6]
Vävnadsspecificitet
[redigera | redigera wikitext]
Papillomvirusets målceller är de basala epitelcellerna och dessa nås normalt via små skador, så kallade mikroabrasioner, i epitelet. Infektionen sprids genom att delningen av infekterade celler, närmast basal lamina, förskjuter äldre infekterade celler mot epitelets apikala yta, varifrån de kan spridas vidare.[25]
Livscykel
[redigera | redigera wikitext]Adsorption till cellytan och passage genom cellmembranet
[redigera | redigera wikitext]Vid infektion binder papillomvirus-kapsidens L1-proteiner till glukosaminoglykaner på målcellens yta, generellt till proteoglykanen heparansulfat,[26] varpå kapsidens struktur förändras. Genom förändringen kan viruset binda till sekundära receptorer som möjliggör upptagande av viruspartikeln inuti en vesikel, genom endocytos.[27] Förändringen innebär även att L2 proteinet får en ny form och aktiveras[26], troligen som ett transmembranprotein i vesikelns membran.[28] Det aktiverade L2 proteinet interagerar med adaptorproteiner, vilka möjliggör vidaretransport i cellen.[24]

Intracellulär transport inklusive avkapsling
[redigera | redigera wikitext]Vesikeln innehållande papillomviruset smälter samman med en endosom i cellen, och i endosomens sura miljö avkapslas viruset, varpå majoriteten av L1 separeras från L2 och virusets DNA. L2 och virusets arvsmassa transporteras i sin vesikel till den cellmembrana sidan av Golgiapparaten där cellens övergång till mitos inväntas.[29] Studier av HPV 16 indikerar att virusbärande vesiklar med L2 och virus DNA under tidig profas transporteras via cellens mikrotubuli till centrosomerna där de ackumuleras, varpå de under prometafas till metafas transporteras ut, via samma nätverk, till kromosomerna.[30][31] Hur L2 och virusets DNA tar sig ur vesikeln är debatterat, men från metafas och genom resten av den mitotiska cykeln tycks L2 och virusets DNA binda till en av kromosomerna, och transporteras därmed in i dottercellens cellkärna.[32]
Transkription, Replikation av arvsmassa
[redigera | redigera wikitext]I HPV31b har RNA som tyder på transkription av de öppna läsramarna E1 och E2 har upptäckts så tidigt som 4 timmar efter att cellkärnan infekterats, och övriga läsramar tog ytterligare några timmar att transkriberas.[33] De proteiner som resulterar från transkriptionen av E1 och E2 bildar helikaser som öppnar upp virusets DNA för replikering. E1 har även visats interagera med proteinkomplex såsom DNA-polymeras för initiering av replikation[34]. Viruset genomgår tre omgångar av replikations-faser, den första replikationen ger ett begränsat antal kopior och sker omgående efter det att cellkärnan infekterats. Den andra replikationsfasen syftar till att upprätthålla ett konstant antal viruspartiklar per cell allteftersom de basala cellerna delar sig.[35] Normalt upphör celldelning i celler som förskjuts uppåt i epitellagret och differentieras, men i celler infekterade med papillomvirus inhiberas tumörsuppressorgener, såsom p53, vilket innebär att cellerna fortsätter att dela sig även när de närmar sig epitelets yta.[36] Den tredje fasen sker då i de differentierade celler som förskjutits uppåt i vävnaden, här ökar det relativa antalet förekommande virala DNA per värdcell drastiskt,[35] med upp till flera tusen per cell.[37]
Kapsidsyntes och spridning av nya viruspartiklar
[redigera | redigera wikitext]Kapsidproteinet L2 har visats syntetiseras innan L1 och de två proteinerna transporteras in i cellkärnan oberoende av varandra, varpå kapsiden bildas kring viruset när proteinerna väl är närvarande.[38] Kapsiderna “mognar” långsammare än kapsiderna hos liknande virus och det spekuleras att detta beror på att papillomvirus har en relativt långsam livscykel till följd av sitt behov av dels basala odifferentierade epitelceller, för att möjliggöra infektion, dels differentierade, mogna och ytliga epitelceller, för att kunna spridas utan att upptäckas av cellens immunsystem.[27][39]
Genetisk organisation och genuttryck
[redigera | redigera wikitext]Papillomvirusets dubbelsträngade-DNA delas in i tre regioner: en tidig (E, från engelskans ‘early’), en sen (L, från engelskans ‘late’) och en lång kontrollerad region (LCR, från engelskans ‘long controlled region’). Den tidiga regionen (E) utgör cirka 50 procent av den totala arvsmassan och kodar för sex öppna läsramar: E1, E2, E4, E5, E6 och E7 och uttrycks till sex stycken virala regulatoriska proteiner[23] som medverkar i transkription[förtydliga], replikation och manipuleringen av den cellulära miljön[6] Två andra öppna läsramar har identifierats: E3 och E8, men genetiska bevis för virusproteinerna E3- och E8 har inte bevisats och vissa medlemmar i familjen Papillom saknar öppna läsramar för E3 och E8.[40]
Den sena regionen (L) tar upp cirka 40 procent av den totala arvsmassan och kodar för virusets två kapsidproteiner: L1 och L2, som bygger upp virusets proteinkapsel.
Den långa kontrollerande regionen (LCR) utgör cirka 10 procent av papillomvirusets genom och är lokaliserad mellan de öppna läsramarna för L1 och E6. LCR-regionen har ingen proteinkodande funktion utan utgör istället regionen för replikation samt bindningsställen för virala och cellulära transkriptionsfaktorer.[6]
Genfunktioner hos papillomvirus
[redigera | redigera wikitext]Nästan all pre-mRNA från papillomvirusets DNA innehåller exoner och introner samt stycken med mer än en läsram. Papillomvirusets DNA kodar för flera proteiner från ett kompakt genom och utnyttjar alternativ splicing för att kunna uttrycka olika typer av proteiner på ett celldifferentieringsspecifikt och tidsmässigt sätt.[23] De virala pre-mRNA innehåller signalsekvenser som signalerar för vart specifika former av alternativ splicing kan ske för att få ut ett färdigt viralt mRNA som kodar för virusets specifika proteiner.
Om och hur proteinerna uttrycks beror på vilket släkte papillomviruset tillhör. Exempelvis så utgör E5-protein inte lika stor funktion hos humant papillomvirus som proteinet gör hos bovint papillomvirus. Det kan även skilja sig med genuttrycket mellan arter av samma släkte.
Proteiner från den tidiga regionen (E)
[redigera | redigera wikitext]E1: Kodar för viralt DNA-helikas och är det enda virala enzymet hos papillomviruset. Viralt DNA-helikas är väsentligt för replikation och amplifiering av virus-DNA i cellkärnan hos infekterade celler.
E2: Kodar för ett regulatoriskt protein. Proteinet är huvudregulator i virusets livscykel och spelar en nyckelroll i transkriptionsreglering, initiering av DNA-replikation och uppdelning av virusets genom.
E4: : E4 proteinet uttrycks vid sena stadier av virusets livscykel, strax före L1 och L2. E4 proteiner uttrycks i en hög koncentration och tros underlätta en effektiv frisättning av virus från en infekterad cell och därmed bidra till virusöverföring.[41] Den höga koncentrationen av E4 kan användas som en indikator på att det finns en aktiv virusinfektion. E4 huvudsakliga funktion hos en infekterad cell är att integrera med cellulärt keratinfilament som resulterar i amyloid-liknande fibrer och utgör en reorganisation av keratinfilamentet.
E5: E5 är ett litet hydrofobiskt transmembranprotein och proteinet kan delas in i olika klasser beroende på virusets fylogeni. E5 är det minsta onkogena proteinet hos papillomvirus och är känd för att kunna bidra till tumörprogression. E5 proteinets aktivitet är inte lika väl kategoriserad som för de onkogena E6 och E7 proteinerna, men anses vara det främsta onkogena proteinet hos Bovin papillomvirus.[42]
E5 proteinet är svårt att detektera eftersom proteinet är extremt hydrofobiskt, lokaliseras främst i membran och endast har ett litet genuttryck vid infektion. E5 interagerar med ett antal av de cellulära proteinerna och interaktionerna är viktiga för proteinets aktivitet vid celltransformation och undvikandet av immunförsvaret. Exempelvis för att hindra tidig apoptos av en infekterad cell kan E5 nedreglera Fas-receptorer och förändra bildningen av dödsinducerande signalkomplexet (DISC) orsakad av fas-ligand-receptor. E5 orsakar en reducering av MHC-klass 1 från cellytan av att låta MHC-klass 1 ackumulera i golgiapparaten. På så vis undviks att den infekterade cellen blir upptäckt av kroppens immunförsvar.
E6: E6 är, tillsammans med E7, ett onkogent protein hos framförallt Humana papillomvirus. E6 och E7 onkogena egenskaper kommer främst genom interaktion med värdcellens regulatoriska proteinkomplex.[43] E6 protein från HVP-16 och HPV-18 stör huvudsakligen tumörsuppressorgenen p53 normala funktioner genom att ubiquitin markerar p53 för nedbrytning. En nedbrytning av p53 förhindrar cellcykeln att stanna i G1-fas, vilket resulterar i att cellen går in i S-fas och börjar replikera DNA. En nedbrytning av p53 resulterar också i att cellen förhindras att gå i apoptos och gör den infekterade cellen odödlig. E6 proteinet påverkar också en ökning av telomerasaktivitet för att försäkra en oändlig profilering av den infekterade cellen.
E7: Kodar för det onkogena proteinet E7 vars huvudsakliga egenskap är att orsaka en degradering av retinoblastomprotein (Rb) vilket leder till tumörprogression.[43] E7 proteinerna har visat sig upprätthålla DNA-syntesens tillstånd i differentierade keratinocyter genom att inhibera p21 och p27, vilket resulterar i fortsatt aktivitet av cyklinberoende-kinas (cdk) och fortsatt vandring i cellcykeln trots onormala cellaktiviteter. E7 proteiner har rapporterats att underlätta integrationen för virusets DNA, orsaka avvikande mitos och upphäva cellcykelns kontrollsystem.
Proteiner från den sena regionen (L)
[redigera | redigera wikitext]Papillomvirusets kapselprotein L1 och L2 är syntetiserade sent under infektionscykeln vars funktion är att inkapsla papillomvirusets cirkulära, dubbelsträngade DNA-mini-kromosom.[3]
L1: Kodar för papillomvirusets kapselprotein som utgör den yttre och därmed den största delen av hela virusets proteinkapsel. L1-proteiner kan spontant montera sig själv till en virusliknande partikel (VLP) utan hjälp från assisterande molekyler. Ytepitoper från L1-proteinet har visat sig vara igenkänningsbara för lymfocyter från kroppens specifika immunförsvar. Upptäckten av ytepitoperna lade grunden för utvecklingen av dagens vaccin mot de cancerframkallande HPV 16 och 18.[44] L1 proteinet har en betydande roll för initiering av infektion av värdcell då proteinet kan integrera med heparansulfat kolhydrater hos plasmamembranets proteoglykaner.[44]
L2: Kodar för det andra kapselproteinet: L2. L2 kan inte, som L1, spontant montera sig själv till en virusliknande partikel men kan bli upptagen när den uttrycks samtidigt med L1 till att bilda virusets proteinkapsel. L2 proteinet är för det mesta begravd under kapsidytan hos mogna papillomvirus, men kan exponera regioner av proteinet vid initiering av infektion via integration mellan L1 och proteoglykaner.[45] Vid exponering kan L2 klyvas av enzymet furin från den extracellulära miljön. Klyvningen av L2 tros vara orsaken till att L2 senare kan integrera med en inträdesreceptor och integrationen mellan receptor och L2 möjliggör virusets entré in i cellen som infekteras.[45]
Referenser
[redigera | redigera wikitext]- ^ Information om klamydia, gonorré och papillomavirus[död länk] (pdf), KI.se, läst 3 juli 2019
- ^ [a b] de Villiers, E.M., Fauquet, C., Broker, T.R., Bernard, H.U., zur Hausen, H. (2004). ”Classification of papillomaviruses”. Virology 324 (1): sid. 17-27.
- ^ [a b c] Lowe, J., Panda, D., Rose, S., Jensen, T., Hughes, W.A., Tso, F.Y., Angaletti, P.C. (2008). ”Evolutionary and structural analyses of alpha-papillomavirus capsid proteins yields novel insights into L2 structure and interaction with L1”. Virolgy Journal 5 (150). doi:.
- ^ [a b] van Doorslaer, K. (2013). ”Evolution of the Papillomaviridae”. Virology 445: sid. 1-2. doi:.
- ^ ”Sjukdomsinformation om HPV-infektion”. Folkhälsomyndigheten. 2016. https://www.folkhalsomyndigheten.se/smittskydd-beredskap/smittsamma-sjukdomar/hpv-infektion/. Läst 23 april 2019.
- ^ [a b c d e f] Van Doorslaer, K., Chen, Z., Bernard, H., Paul, C., Desalle, R., Dillner, J., Forslund, O., Haga, T., McBride, A., Villa, L., Burk, R. (2018). ”Papillomaviridae”. Virus Taxonomy: 2018b Release. EC 50 (Washington D.C.: ICTV). https://talk.ictvonline.org/ictv-reports/ictv_online_report/dsdna-viruses/w/papillomaviridae.
- ^ Bernard, H. (2013). ”Taxonomy and phylogeny of papillomaviruses: An overview and recent developments”. Infection, Genetics and Evolution 18: sid. 357-361. doi:.
- ^ Axelsson.I, Collberg.P, Silfverdal.S.A. (2019). ”Vaccination av ungdomar”. https://www.internetmedicin.se/page.aspx?id=2144. Läst 25 mars 2019.
- ^ Iwarson, S. (2011). Infektionsmedicin, epidemiologi, klinik, terapi (5). Sävedalen: Säve Förlag. sid. 240
- ^ Wahren, P. & B. (2007). Framtidens farliga smitta - Hur kan vi skydda oss?. Stockholm: Karolinska Institutet University Press
- ^ Lindahl.G & Borgfeldt.C. (2018). ”Cervix Cancer”. https://www.internetmedicin.se/page.aspx?id=2735. Läst 23 mars 2019.
- ^ ”Penile Cancer”. NHS. 2017. https://www.nhs.uk/conditions/penile-cancer/#). Läst 23 mars 2019.
- ^ Holmes K., Sparling, P., Stamn, W., Piot, P., Wasserheit, J., Corey, L., Cohen, M. (2007). Sexually Transmitted Diseases (4). McGraw-Hill Professional
- ^ Munck-Wikland, E., Attner, P., Näsman, A., Hammarstedt, L., Ramqvist, T., Dalianis, T. (2010). ”Epidemisk ökning av tonsill- och tungbascancer”. Förklaring: Parallell ökning av HPV-infektioner. Arkiverad från originalet den 31 mars 2016. https://web.archive.org/web/20160331142158/http://www.lakartidningen.se/Functions/OldArticleView.aspx?articleId=14646. Läst 6 maj 2019.
- ^ Rector, Annabel; Van Ranst, Marc (2013-10). ”Animal papillomaviruses” (på engelska). Virology 445 (1-2): sid. 213–223. doi:. https://linkinghub.elsevier.com/retrieve/pii/S0042682213002663.
- ^ ”Papillomavirus Episteme”. National institute of Allergy and Infectious Diseases U.S Government. https://pave.niaid.nih.gov/#search/search_database/kw?dbNamespace=Genomes&includeNR=false&refCloneOnly=false&sort=Locus_ID&sortType=true&page=600&start=1&text=HPV&showTable=1&. Läst 2 april 2019.
- ^ Cheville, N. (2014). ”Papillomatosis Then and Now”. Veterinary Pathology 51 (6): sid. 1049-1050. doi:.
- ^ [a b] Daudt, C., da Silva, F.R.C., Cibulski, S.P., Streck, A.F., Laurie, R.E., Munday, J.S., Canal, C.W. (2019). ”Bovine papillomavirus 24: a novel member of the genus Xipapillomavirus detected in the Amazon region”. Archives of Virology 164 (2): sid. 637-641. doi:.
- ^ Dagalp, S.B., Dogan, F., Farzani, T.A., Salar, S., Bastan, A. (2017). ”The genetic diversity of bovine papillomaviruses (BPV) from different papillomatosis cases in dairy cows in Turkey”. Archives of Virology 162 (2): sid. 1507-1518. doi:.
- ^ Nasir, Lubna; Campo, M Saveria (2008-10). ”Bovine papillomaviruses: their role in the aetiology of cutaneous tumours of bovids and equids”. Veterinary Dermatology 19 (5): sid. 243–254. doi:. http://doi.wiley.com/10.1111/j.1365-3164.2008.00683.x.
- ^ Robles-Sikisakaa, R., Rivera, R., Nollens, H.H., St. Leger, J., Durden, W.N., Stolen, M., Burchell, J., Wellehan Jr, J.F.X. (2012). ”Evidence of recombination and positive selection in cetacean papillomaviruses”. Virology 427 (2): sid. 189-197. doi:.
- ^ Chen, Z., Ho, W., Boon, S.S., Law, P., Chan, M., DeSalle, R., Chan, P. (2017). ”Ancient Evolution and Dispersion of Human Papillomavirus 58 Variants”. Journal of Virology 91 (21). doi:.
- ^ [a b c] Zheng, Z.M., Baker, C.C. (2006). ”Papillomavirus genome structure, expression, and post-transcriptional regulation”. Frontiers in bioscience : a journal and virtual library 11: sid. 2286-2302.
- ^ [a b] Bergant Marušič, M., Ozbun, M. A., Campos, S. K., Myers, M.P., Banks, L. (2019). ”Human Papillomavirus L2 Facilitates Viral Escape from Late Endosomes via Sorting Nexin 17”. Traffic 13: sid. 455-467. doi:.
- ^ Murall, C. L., Jackson, R., Zehbe, I., Boulle, N., Segondy, M., Alizon, S. (2019). ”Epithelial stratification shapes infection dynamics.”. PLoS computational biology 15 (1). doi:.
- ^ [a b] Schelhaas, M., Shah, B., Holzer, M., Blattmann, P., Kühling, L., et al. (2012). ”Entry of Human Papillomavirus Type 16 by Actin-Dependent, Clathrin- and Lipid Raft-Independent Endocytosis”. PLoS Pathogens 8 (4). doi:.
- ^ [a b] Doorbar, J., Quint, W., Banks, L., Bravo, I.G., Stoler, M., Broker, T.R., Stanley, M.A. (2015). ”The Biology and Life-Cycle of Human Papillomaviruses”. Vaccine 30 (5). doi:.
- ^ DiGiuseppe, S., Keiffer, T.R., Bienkowska-Haba, M., Luszczek, W., Guion, L.G., Müller, M., Sapp, M. (2015). ”Topography of the Human Papillomavirus Minor Capsid Protein L2 during Vesicular Trafficking of Infectious Entry”. Journal of Virology 89 (20): sid. 10442-10452. doi:.
- ^ Campos, S.K. (2017). ”Subcellular Trafficking of the Papillomavirus Genome during Initial Infection: The Remarkable Abilities of Minor Capsid Protein L2”. Viruses 9 (12): sid. 370. doi:.
- ^ Siddiqa, A., Massimi, P., Pim, D., Broniarczyk, J., Banks, L. (2018). ”Human Papillomavirus 16 Infection Induces VAP-Dependent Endosomal Tubulation”. Journal of Virology 92 (6). doi:.
- ^ DiGiuseppe, S., Luszczek, W., Keiffer, T. R., Bienkowska-Haba, M., Guion, L. G., & Sapp, M. J. (2016). ”Incoming human papillomavirus type 16 genome resides in a vesicular compartment throughout mitosis”. Proceedings of the National Academy of Sciences of the United States of America 113 (22): sid. 6289-6294. doi:.
- ^ Calton, C.M., Bronnimann, M.P., Manson, A.R., Li, S., Chapman, J.A., Suarez-Berumen, M., Campos, S.K. (2017). ”Translocation of the papillomavirus L2/vDNA complex across the limiting membrane requires the onset of mitosis”. PLoS Pathogens 13 (5). doi:.
- ^ Ozbun, M.A. (2002). ”Human Papillomavirus Type 31b Infection of Human Keratinocytes and the Onset of Early Transcription.”. Journal of Virology 76 (22): sid. 11291-11300. doi:.
- ^ Wilson, V.G., West, M., Woytek, K., Rangasamy, D. (2002). ”Papillomavirus E1 proteins: form, function, and features.”. Virus Genes 24 (3): sid. 275-290. doi:.
- ^ [a b] McBride, A.A. (2013). ”The papillomavirus E2 proteins”. Virology 445 (1-2): sid. 57-79. doi:.
- ^ Sherman, L., Jackman, A., Itzhaki, H., Conrad Stöppler, M., Koval, D., Schlegel, R. (1997). ”Inhibition of Serum- and Calcium-Induced Differentiation of Human Keratinocytes by HPV16 E6 Oncoprotein: Role of p53 Inactivation”. Virology 237 (2): sid. 296-306. doi:.
- ^ Graham, S.V. (2017). ”The human papillomavirus replication cycle, and its links to cancer progression: a comprehensive review”. Clinical Science 131 (17): sid. 2201-2221. doi:.
- ^ Florin, L., Sapp, C., Streeck, R.E., Sapp, M. (2002). ”Assembly and Translocation of Papillomavirus Capsid Proteins”. Journal of Virology 79 (19): sid. 10009-10014. doi:.
- ^ Buck, C.B., Thompson, C.D., Pang, Y.Y.S., Lowy, D.R., Schiller, J.T. (2005). ”Maturation of Papillomavirus Capsids”. Journal of Virology 79 (5): sid. 2839-2846. doi:.
- ^ Bernard, H.-U., Burk, R.D., deVilliers, E.-M. and zur Hausen, H. (2011). Papillomaviridae - Taxonomy - Then and Now. ICTV. Arkiverad från originalet den 24 april 2019. https://web.archive.org/web/20190424160930/https://talk.ictvonline.org/ictv-reports/ictv_9th_report/dsdna-viruses-2011/w/dsdna_viruses/121/papillomaviridae. Läst 6 maj 2019.
- ^ Doorbar, J. (2013). ”The E4 protein; structure, function and patterns of expression”. Virology 445 (1-2): sid. 80-98. doi:.
- ^ Venuti, A., Paolini, F., Nasir, L., Corteggio, A., Roperto, S., Campo, M. S., & Borzacchiello, G. (2011). ”Papillomavirus E5: the smallest oncoprotein with many functions”. Molecular Cancer 10: sid. 140. doi:.
- ^ [a b] Zhu, Y., Wang, Y., Hirschhorn, J., Welsh, K.J., Zhao, Z., Davis, M.R., Feldman, S. (2017). ”Human Papillomavirus and Its Testing Assays, Cervical Cancer Screening, and Vaccination”. Advances in Clinical Chemistry 81: sid. 135-192. doi:.
- ^ [a b] Buck, C. B., Day, P. M., & Trus, B. L. (2013). ”The papillomavirus major capsid protein L1”. Virology 445. doi:.
- ^ [a b] Wang, J. W., & Roden, R. B. (2013). ”L2, the minor capsid protein of papillomavirus”. Virology 445 (1-2): sid. 175-186. doi:.