Fosforoxitriklorid
| Fosforoxitriklorid | |
  | |
| Systematiskt namn | Fosforoxitriklorid |
|---|---|
| Övriga namn | Fosforoxylklorid, Fosforylklorid |
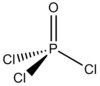
| Kemisk formel | POCl3 |
| Molmassa | 153,33 g/mol |
| Utseende | Färglös vätska |
| CAS-nummer | 10025-87-3 |
| SMILES | ClP(=O)(Cl)Cl |
| Egenskaper | |
| Densitet | 1,645 g/cm³ |
| Löslighet (vatten) | Hydrolys |
| Smältpunkt | 1,25 °C |
| Kokpunkt | 105,8 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 36 mg/kg (oralt) |
| SI-enheter & STP används om ej annat angivits | |
Fosforoxitriklorid (POCl3) är en kemisk förening av fosfor, syre och klor.
Egenskaper
[redigera | redigera wikitext]Det är ett aggressivt och starkt frätande ämne, som fräter sönder det mesta det kommer i kontakt med. Man måste ha ett speciellt tillstånd för att hantera ämnet, eftersom man kan tillverka stridsgas av det. I fuktig luft hydrolyseras fosforoxitriklorid och bildar fosforsyra och saltsyra.
P=O bindningen är en mycket stark dubbelbindning med en energi på 533,5 kJ/mol.
Framställning
[redigera | redigera wikitext]Fosforoxitriklorid kan framställas genom att oxidera fosfortriklorid (PCl3) med syrgas (luft är ineffektivt).
Ett alternativt sätt är att reagera fosforpentaklorid (PCl5) med fosforpentoxid (P4O10).
Eftersom båda ämnena är fasta brukar man i stället för fosforpentaklorid använda en lösning av fosforpentoxid i fosfortriklorid. När klorgas bubblas genom lösningen bildas fosforpentaklorid som sedan reagerar med fosforpentoxiden.
Användning
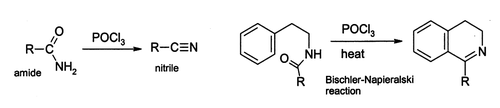
[redigera | redigera wikitext]Ämnet har stor användning in organisk syntes. Den reagerar med alkoholer under bildning av organiska fosforsyraestrar. Den kan även användas för dehydrogenering av exempelvis primära amider, varvid nitriler erhålls.
Se även
[redigera | redigera wikitext]Källor
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Phosphoryl chloride, tidigare version.