Dien

Inom organisk kemi är en dien ett omättat kolväte som består av en kedja kolatomer som innehåller två dubbelbindningar.[1] Den tillhör alkenerna, en ämnesklass med minst en kol-koldubbelbindning. Den generella summaformeln är CnH2n-2. Se även alken. Som en underenhet av mer komplexa molekyler förekommer diener i naturligt förekommande och syntetiska kemikalier och används i organisk syntes. Konjugerade diener används ofta som monomerer i polymerindustrin. Fleromättade fetter är av intresse som näringsämne.
Klasser
[redigera | redigera wikitext]Diener kan delas in i tre klasser, beroende på dubbelbindningarnas relativa placering:[1]
- Kumulerade diener har dubbelbindningar som delar en gemensam atom. Resultatet kallas mer specifikt en allen.
- Konjugerade diener har konjugerade dubbelbindningar separerade av en enkelbindning. Konjugerade diener är stabilare än andra diener på grund av resonans.
- Okonjugerade diener har dubbelbindningarna åtskilda av två eller flera enkelbindningar. De är vanligtvis mindre stabila än isomera konjugerade diener. Detta kan också kallas en isolerad dien.

Enligt Gold Book-definitionen kan en "dien" inkludera en eller flera heteroatomer som ersätter omättade kolatomer, vilket ger strukturer som mer specifikt kan kallas heterodiener.[1]
Föreningar som innehåller mer än två dubbelbindningar kallas polyener. Polyener och diener delar många egenskaper.
Syntes av diener
[redigera | redigera wikitext]I industriell skala framställs butadien genom termisk krackning av butaner. I en liknande ickeselektiv process erhålls dicyklopentadien från stenkolstjära.
I laboratoriet används mer riktade och mer känsliga processer som dehydrohalogenationer och kondensationer. Många metoder har utvecklats, såsom Whiting-reaktionen. Familjer av ickekonjugerade diener härrör från oligomerisering och dimerisering av konjugerade diener. Exempelvis framställs 1,5-cyklooktadien och vinylcyklohexen genom dimerisering av 1,3-butadien.
Dienhaltiga fettsyror biosyntetiseras från acetyl-CoA.
α,ω-diener har formeln (CH2)n(CH=CH2)2. De framställs industriellt genom ethenolys av cykliska diener. Exempelvis framställs 1,5-hexadien och 1,9-dekadien, användbara tvärbindningsmedel och syntetiska intermediärer, från 1,5-cyklooctadien respektive cyklookten. Katalysatorn härrör från Re2O7 på aluminiumoxid.[2]
Reaktivitet och användning
[redigera | redigera wikitext]Polymrisation
[redigera | redigera wikitext]Den mest praktiserade reaktionen av alkener, inklusive diener, är polymerisation. 1,3-butadien är råmaterial till gummi som används i däck, och isopren är råvara till naturgummi. Kloropren är besläktat, men det är en syntetisk monomer.
Cykloadditioner
[redigera | redigera wikitext]En viktig reaktion för konjugerade diener är Diels–Alder-reaktionen. Många specialiserade diener har utvecklats för att utnyttja denna reaktivitet för syntes av naturliga produkter (till exempel Danishefskys dien).
Andra tilläggsreaktioner
[redigera | redigera wikitext]Konjugerade diener tillför reagenser såsom brom och väte genom både 1,2-addition och 1,4-additionsvägar. Tillsats av polära reagenser kan generera komplexa arkitekturer:[3]
Metatesreaktioner
[redigera | redigera wikitext]Icke-konjugerade diener är substrat för ringstängande metatesreaktioner. Dessa reaktioner kräver en metallkatalysator:
Surhet
[redigera | redigera wikitext]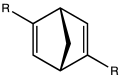
Positionen intill en dubbelbindning är sur eftersom den resulterande allylanjonen stabiliseras genom resonans. Denna effekt blir mer uttalad eftersom fler alkener är inblandade för att skapa större stabilitet. Till exempel ger deprotonering vid position 3 av en 1,4-dien eller position 5 av en 1,3-dien en pentadienylanjon. En ännu större effekt ses om anjonen är aromatisk, till exempel deprotonering av cyklopentadien för att ge cyklopentadienylanjonen.
Som ligander
[redigera | redigera wikitext]Diener används ofta kelaterande ligander i organometallisk kemi. I vissa fall fungerar de som platshållarligander och tas bort under en katalytisk cykel. Till exempel är cyklooktadien ("cod") liganderna ibis(cyklooctadien)nickel(0)labila. I vissa fall är diener åskådarligander, som förblir samordnade under en katalytisk cykel och påverkar produktfördelningarna. Kiraladiener har också beskrivits.[5] Andra dienkomplex inkluderar (butadien) järntrikarbonyl, cyklobutadieneiron trikarbonyl och cyklooktadien rodiumkloriddimer.
Se även
[redigera | redigera wikitext]Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Diene, 13 februari 2022.
Noter
[redigera | redigera wikitext]- ^ [a b c] IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "dienes". doi:10.1351/goldbook.D01699
- ^ Lionel Delaude, Alfred F. Noels (2005). ”Metathesis”. Kirk-Othmer Encyclopedia of Chemical Technology. Weinheim: Wiley-VCH. doi:. ISBN 0471238961.
- ^ Roger Bishop. "9-Thiabicyclo[3.3.1]nonane-2,6-dione". Organic Syntheses.; Collective Volume, vol. 9, p. 692Díaz, David Díaz; Converso, Antonella; Sharpless, K. Barry; Finn, M. G. (2006). "2,6-Dichloro-9-thiabicyclo[3.3.1]nonane: Multigram Display of Azide and Cyanide Components on a Versatile Scaffold". Molecules. 11 (4): 212–218. doi:10.3390/11040212. PMC 6148556. PMID 17962753.
- ^ ”A Chiral Chelating Diene as a New Type of Chiral Ligand for Transition Metal Catalysts: Its Preparation and Use for the Rhodium-Catalyzed Asymmetric 1,4-Addition”. J. Am. Chem. Soc. 125 (38): sid. 11508–11509. 2003. doi:. PMID 13129348.
- ^ Ryo Shintani, Tamio Hayashi, "Chiral Diene Ligands for Asymmetric Catalysis" Aldrich Chimica Acta 2009, vol. 42, number 2, pp. 31-38.
|

![2,6-Dikloro-9-tiabicyklo[3.3.1]nonan, synteser och reaktioner](http://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/CODSCl2.png/450px-CODSCl2.png)
