Acetoacetat
| Acetoacetat | |
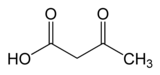  | |
| Systematiskt namn | 3-Oxobutanoic acid[1] |
|---|---|
| Övriga namn | Diättiksyra |
| Kemisk formel | C4H6O3 |
| Molmassa | 102,089 g/mol |
| Utseende | Färglös, oljig vätska |
| CAS-nummer | 541-50-4 |
| SMILES | O=C(O)CC(C)C |
| Egenskaper | |
| Smältpunkt | 36,5 °C |
| Kokpunkt | 176,5 °C |
| SI-enheter & STP används om ej annat angivits | |
Acetoacetat eller diättiksyra, är en keton som bland annat bildas av kroppen vid ketos. Den är den enklaste beta-ketosyran, och som andra medlemmar i den här klassen är den instabil. Metyl- och etylestrarna, som är ganska stabila, produceras i stor skala industriellt som råvara till färgämnen. Acetoacetat är en svag syra.[2]
Acetoacetat kan användas som substrat för att bilda ATP under omständigheter med låga glukosnivåer i blodet, som vid ketoacidos eller ketogen diet.
Biokemi
[redigera | redigera wikitext]Acetoacetat produceras i mitokondrierna i levern från acetoacetylkoenzym A (CoA). Först tillsätts en annan acetylgrupp från acetyl CoA för att bilda 3-hydroxi-3-metylglutaryl CoA, sedan förloras en acetyl CoA från detta, vilket ger acetoacetat. Det initiala acetoacetatet kan komma från den sista cykeln i beta-oxidationen av en fettsyra, eller kan syntetiseras från två acetyl CoA-molekyler, katalyserade av tiolas.[3]
Hos däggdjur frigörs acetoacetat som produceras i levern (tillsammans med de andra två "ketonkropparna") i blodomloppet som en energikälla under perioder med fasta, träning eller som ett resultat av typ 1-diabetes mellitus.[4] För det första överförs en CoA-grupp enzymatiskt till den från succinyl-CoA och omvandlar den tillbaka till acetoacetyl CoA. Detta bryts i två acetyl CoA-molekyler av tiolas, och dessa går sedan in i citronsyracykeln. Hjärtmuskel och njurbark föredrar acetoacetat framför glukos. Hjärnan använder acetoacetat när glukosnivåerna är låga på grund av fasta eller diabetes.[3]
Syntes och egenskaper
[redigera | redigera wikitext]Acetoacetat kan framställas genom hydrolys av diketen. Dess estrar produceras analogt via reaktionen mellan diketen och alkoholer,[2] och acetoacetat kan framställas genom hydrolys av dessa ämnen.[5] I allmänhet genereras acetoacetat vid 0 °C och används omedelbart på plats.[6] Den sönderdelas i måttlig takt till aceton och koldioxid:
- CH3C(O)CH2CO2H → CH3C(O)CH3 + CO2
Syraformen har en halveringstid på 140 minuter vid 37 °C i vatten, medan basformen (anjonen) har en halveringstid på 130 timmar. Det vill säga det reagerar ungefär 55 gånger långsammare.[7] Den är en svag syra (som de flesta alkylkarboxylsyror), med ett pKa på 3,58.
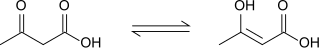
Acetoactat uppvisar keto-enol-tautomerisering, där enolformen delvis stabiliseras genom förlängd konjugering och intramolekylär H-bindning. Jämvikten är starkt lösningsmedelsberoende med ketoformen som dominerar i polära lösningsmedel (98 procent i vatten) och enolformen står för 25-49 procent av materialet i icke-polära lösningsmedel.[8]
Användning
[redigera | redigera wikitext]
Acetoättikestrar används för acetoacetyleringsreaktionen, som används i stor utsträckning vid framställning av färger som arylidgult och diarylidgult.[2] Även om estrarna kan användas i denna reaktion, reagerar diketen också med alkoholer och aminer på motsvarande ättiksyraderivat i en process som kallas acetoacetylering. Ett exempel är reaktionen med 4-aminoindane:[9]
Detektering
[redigera | redigera wikitext]Acetoacetat mäts i urinen hos personer med diabetes för att testa för ketoacidos[10] och för att övervaka personer på en ketogen eller lågkolhydratdiet.[11][12] Detta görs med mätstickor belagda med nitroprussid eller liknande reagenser. Nitroprussid ändras från rosa till lila i närvaro av acetoacetat, den konjugerade basen av acetoättiksyra, och färgförändringen graderas med ögat. Testet mäter inte β-hydroxibutyrat, den vanligaste ketonen i kroppen. Under behandling av ketoacidos omvandlas β-hydroxibutyrat till acetoacetat så testet är inte användbart efter att behandlingen har börjat[10] och kan vara falskt låg vid diagnos.[13]
Liknande tester används i mjölkkor för att testa för ketos.[14]
Referenser
[redigera | redigera wikitext]- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Acetoacetic acid, 26 maj 2022.
Noter
[redigera | redigera wikitext]- ^ ”Front Matter”. Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. Sid. 748. doi:. ISBN 978-0-85404-182-4.
- ^ [a b c] Franz Dietrich Klingler; Wolfgang Ebertz (2005). ”Oxocarboxylic Acids”. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:. ISBN 978-3527306732.
- ^ [a b] Lubert Stryer (1981). Biochemistry (2nd).
- ^ Stryer, Lubert (1995). Biochemistry. (Fourth). New York: W.H. Freeman and Company. Sid. 510–515, 581–613, 775–778. ISBN 0 7167 2009 4.
- ^ Robert C. Krueger (1952). ”Crystalline Acetoacetic Acid”. Journal of the American Chemical Society 74 (21): sid. 5536. doi:.
- ^ Reynolds, George A.; VanAllan, J. A. (1952). "Methylglyoxal-ω-Phenylhydrazone". Organic Syntheses. 32: 84. doi:10.15227/orgsyn.032.0084.; Collective Volume, vol. 4, p. 633
- ^ Hay, R. W.; Bond, M. A. (1967). ”Kinetics of decarboxilation of acetoacetic acid”. Aust. J. Chem. 20 (9): sid. 1823–8. doi:.
- ^ Grande, Karen D.; Rosenfeld, Stuart M. (1980). ”Tautomeric equilibriums in acetoacetic acid”. The Journal of Organic Chemistry 45 (9): sid. 1626–1628. doi:. ISSN 0022-3263.
- ^ Kiran Kumar Solingapuram Sai; Thomas M. Gilbert; Douglas A. Klumpp (2007). ”Knorr Cyclizations and Distonic Superelectrophiles”. J. Org. Chem. 72 (25): sid. 9761–9764. doi:. PMID 17999519.
- ^ [a b] Nyenwe, EA; Kitabchi, AE (April 2016). ”The evolution of diabetic ketoacidosis: An update of its etiology, pathogenesis and management”. Metabolism: Clinical and Experimental 65 (4): sid. 507–21. doi:. PMID 26975543.
- ^ Hartman, AL; Vining, EP (January 2007). ”Clinical aspects of the ketogenic diet”. Epilepsia 48 (1): sid. 31–42. doi:. PMID 17241206.
- ^ Sumithran, Priya; Proietto, Joseph (2008). ”Ketogenic diets for weight loss: A review of their principles, safety and efficacy”. Obesity Research & Clinical Practice 2 (1): sid. I-II. doi:. PMID 24351673.
- ^ Misra, S; Oliver, NS (28 October 2015). ”Diabetic ketoacidosis in adults.”. BMJ (Clinical Research Ed.) 351: sid. h5660. doi:. PMID 26510442. http://spiral.imperial.ac.uk/bitstream/10044/1/41091/2/bmj.h5660.full.pdf.
- ^ Tatone, EH; Gordon, JL; Hubbs, J; LeBlanc, SJ; DeVries, TJ; Duffield, TF (1 August 2016). ”A systematic review and meta-analysis of the diagnostic accuracy of point-of-care tests for the detection of hyperketonemia in dairy cows.”. Preventive Veterinary Medicine 130: sid. 18–32. doi:. PMID 27435643.
Externa länkar
[redigera | redigera wikitext] Wikimedia Commons har media som rör Acetoacetat.
Wikimedia Commons har media som rör Acetoacetat.

